
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основы химической кинетики
|
|
Химической кинетикой называется раздел химии, изучающий динамику перехода системы из начального в конечное состояние. Таким образом, термохимия и кинетика дополняют друг друга и позволяют детально изучить весь химический процесс.
Краеугольными понятиями кинетики являются механизм реакции и ее скорость. Основные методы их изучения – экспериментальные. Под механизмом реакции понимают совокупность и последовательность элементарных стадий и промежуточных продуктов и частиц, встречающихся при переходе системы из начального в конечное состояние. Стехиометрическое уравнение реакции редко отражает истинный ход процесса. Оно показывает лишь суммарные количественные соотношения.
Обсудим некоторые важные понятия химической кинетики.
1. Элементарная стадия - каждая отдельная стадия процесса, в ходе которой характеристики системы меняются монотонно. Эта стадия не может быть разложена на более простые. Элементарные стадии бывают мономолекулярные (заключаются в химическом превращении одной молекулы при получении ею дополнительной энергии), бимолекулярные (превращение двух молекул или частиц, которое происходит при обязательном их столкновении) и тримолекулярные (требуют одновременного столкновения трех частиц). Элементарных стадий большей молекулярности не бывает, так как вероятность столкновения четырех и более частиц практически равна нулю.
2. Фаза – часть системы, отделенная от других поверхностью раздела. При переходе вещества из фазы в фазу, его свойства меняются скачкообразно. Это легко продемонстрировать на следующем примере. Двумя разными фазами являются несмешивающиеся жидкости. Если растворенное вещество переходит из одного растворителя в другой, его взаимодействие с растворителем, а значит, и энергия, резко меняются.
3. Гомогенная система – система, состоящая только из одной фазы. Гетерогенная система состоит из нескольких фаз. Очевидно, что если реагенты находятся в разных фазах, это приводит к некоторым особенностям в их взаимодействиях в отличие от реакции в гомогенной среде. Реакция в гетерогенной системе протекает только на поверхности раздела фаз. Очевидно, что эта поверхность должна быть как можно больше, и реагенты должны легко подходить к ней. Поэтому гетерогенные реакции проводят при интенсивном перемешивании, дроблении, а иногда и специальной подготовке твердой фазы. При близкой природе реагентов реакции в гетерогенной системе обычно проходят медленнее, чем в гомогенной.
Употребив слово «медленнее», мы незаметно подошли к основному понятию химической кинетики: скорость химической реакции. Скорость реакции можно измерять по убыли исходных веществ. Тогда это количество вещества, прореагировавшее в единицу времени в единице объема. Скорость по продуктам – это количество вещества, образовавшееся в единицу времени в единице объема.
Большинство реакций протекает без изменения объема. Тогда количество вещества (число моль) в единице объема – это его молярная концентрация. В соответствии с определением, для вычисления скорости реакции следует изменение молярной концентрации участника процесса за определенный отрезок времени (С2 – С1) разделить на величину этого отрезка (τ 2 – τ 1). Скорость реакции по определению величина положительная, поэтому отношение изменения молярной концентрации реагентов ко времени реакции должно быть взято со знаком “-“, так как количество реагентов в ходе реакции уменьшается, и ∆ С для них будет отрицательной. В конечном счете, имеем уравнение:
V =  - для реагентов и V =
- для реагентов и V =  - для продуктов реакции. Размерность скорости реакции – моль/л.с.
- для продуктов реакции. Размерность скорости реакции – моль/л.с.
Как уже говорилось, валовая скорость гетерогенной реакции тем больше, чем больше поверхность раздела фаз. Когда же хотят сравнить между собой две скорости гетерогенных реакций, то относят их к единице поверхности, чтобы при сравнении исключить зависимость от площади поверхности (S):
V = - 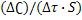 .
.
Время протекания химических реакций меняется в очень широких пределах – от миллионных долей секунды до миллионов лет. Ученые установили, какие факторы влияют на величину скорости реакции. Перечислим их в том порядке, в каком будем обсуждать (напомню, что особенности влияния площади поверхности раздела фаз на скорость гетерогенных реакций мы уже обсудили): концентрация реагентов, природа реагирующих веществ, температура, присутствие катализатора.
|
|