
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация коррозионных процессов
|
|
1. По характеру поражения:
- сплошная (равномерная, неравномерная и селективная)
- местная (пятнами, язвами, питтингами, сквозная и межкристаллитная).
2. По значению рН: кислая, нейтральная и щелочная.
3. По механизму химических процессов:
- химическая, электрохимическая и электрокоррозия.
Химическая коррозия – это коррозия под действием сухих газов, т.е. без участия влаги. Этот вид коррозии встречается сравнительно редко, например, при высокотемпературной обработке металлов, в двигателях внутреннего сгорания, в реактивных двигателях. При химической коррозии происходит непосредственный переход электронов от металла к окислителю.
Значительно более распространенной является электрохимическая коррозия (гальванокоррозия). Уже само название показывает, что в этом случае имеют место процессы, сходные с теми, которые протекают при работе гальванического элемента.
Так же, как и для работы гальванического элемента, для протекания процесса гальванокоррозии необходимо наличие двух электродов и раствора электролита. Значит, чистые металлы теоретически вообще не должны подвергаться электрохимической коррозии. Однако, металлы, применяемые в технике, всегда содержат примеси. При соприкосновении металла с раствором электролита на его поверхности возникает большое число непрерывно действующих микрогальванических элементов. При этом, как и в обычных гальванических элементах, разрушается более активный металл.
Растворение металла и разряд катионов электролита происходят на различных участках металла. Участок поверхности, с которого ионы переходят в раствор, т.е. участок, где металл корродирует, является анодом, а участок, на котором разряжаются катионы электролита, является катодом.
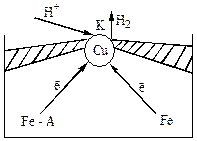 На рис. показан железный лист с медной заклепкой, погруженный в раствор соляной кислоты
На рис. показан железный лист с медной заклепкой, погруженный в раствор соляной кислоты
Более активный металл - железо (анод), менее активный – медь (катод).

Если при коррозии на катодных участках выделяется водород, говорят, что коррозия происходит с водородной деполяризацией.
В растворах с малой концентрацией водорода (нейтральных, слабощелочных и слабокислых), катодные процессы протекают с кислородной деполяризацией (pH  7). Такие процессы, происходящие в природе, называют атмосферной коррозией, т.к. природная вода, а также влага, конденсирующаяся на поверхности металла, обычно содержат растворенный кислород. Анодом является более активный металл, на катоде восстанавливается кислород:
7). Такие процессы, происходящие в природе, называют атмосферной коррозией, т.к. природная вода, а также влага, конденсирующаяся на поверхности металла, обычно содержат растворенный кислород. Анодом является более активный металл, на катоде восстанавливается кислород:
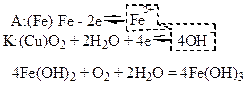 В стали, которая имеет неоднородный состав (кристаллическое железо, зерна цементита Fe3C и свободный углерод), анодом становится железо, а катодом - цементит и углерод.
В стали, которая имеет неоднородный состав (кристаллическое железо, зерна цементита Fe3C и свободный углерод), анодом становится железо, а катодом - цементит и углерод.
|
|