
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция 9. Металлы и их свойства. Коррозия металлов.
|
|
Металлы обладают рядом характерных физических свойств, к которым относятся:
1) высокая электропроводность;
2) высокая теплопроводность;
3) способность к пластической деформации;
4) металлический блеск, непрозрачность для всех длин волн видимого света;
5) твердость;
6) упругость.
Лучшими проводниками тепла и электричества являются серебро, медь, золото и алюминий; несколько хуже проводят тепло и электричество титан и железо, еще хуже – свинец и ртуть.
Как сильные восстановители, металлы взаимодействуют с различными окислителями: типичными неметаллами, солями менее активных металлов, кислотами и т.д.
1. При нагревании многие металлы реагируют с водородом, образуя гидриды – твердые кристаллические вещества.
2Na + H2 = 2NaH
2. Чем левее в ряду напряжений расположен металл, тем он активнее, следовательно, каждый металл в ряду напряжений вытесняет (восстанавливает) все последующие металлы из растворов их солей.
Например, медь вытесняет серебро из раствора его соли:
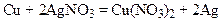
3. Металлы, гидроксиды которых растворимы в воде, взаимодействуют с водой. При этом образуются гидроксид металла и водород:

В то же время алюминий практически не вытесняет водород из воды. Это объясняется тем, что поверхность алюминия покрыта тонким (0, 02 – 0, 1мк) плотным слоем оксида алюминия Al2O3; нерастворимая в воде пленка оксида препятствует взаимодействию алюминия с водой.
4. Характер взаимодействия металлов с кислотой зависит от активности металла, а также от свойств и концентрации кислоты.
При взаимодействии металлов, стоящих в ряду активности до водорода, с галогенводородными кислотами и разбавленной серной кислотой вытесняется газообразный водород и образуется соль.
Однако, если образующаяся в ходе реакции соль нерастворима в воде, то на поверхности металла образуется защитная пленка и реакция прекращается.
С концентрированной серной кислотой взаимодействуют многие металлы, но водород при этом не выделяется. Малоактивные металлы (например, Cu, Hg) восстанавливают концентрированную серную кислоту до SO2.
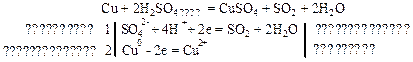
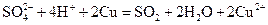
Металлы средней активности (например, Co, Ni и др.) восстанавливают серную кислоту до свободной серы:
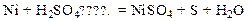
Активные металлы (например, Zn, Mg) восстанавливают концентрированную серную кислоту до сероводорода H2S.
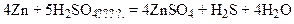
Азотная кислота является одним из самых сильных окислителей. Она взаимодействует почти со всеми металлами, образуя при этом целый ряд продуктов восстановления, но водород при этом не выделяется.
При взаимодействии с неактивными металлами концентрированная азотная кислота восстанавливается до диоксида азота NO2:

В случае взаимодействия с неактивными металлами (кроме благородных) разбавленная азотная кислота восстанавливается до оксида азота NO:

С металлами средней активности (Ni, Cd, и др.) разбавленная азотная кислота восстанавливается до свободного азота N2.

С активными металлами разбавленная азотная кислота восстанавливается до N2O и даже до 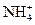 (или NH3):
(или NH3):
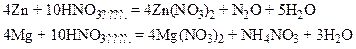
Разрушение металла, вызываемое его химическим или электрохимическим взаимодействием с агрессивными компонентами окружающей среды, называется коррозией.
|
|