
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные признаки протекания гетерогенного процесса
|
|
| Область | Признаки | Энергия активации, кДж/моль | |
| Кинетическая | Скорость зависит от температуры, не зависит от перемешивания и длительности процесса | 40-300 | |
| Переходная | Скорость зависит от температуры и от перемешивания | 20-40 | |
| Диффузионная | Внутренняя диффузия | Скорость не зависит от температуры и перемешивания, пропорциональна концентрации растворителя и постепенно снижается со временем | 8-20 |
| Внешняя диффузия | Скорость зависит от перемешивания и концентрации растворителя, почти не зависит от температуры | 8-16 |
Растворение твердых тел является типичным гетерогенным процессом. Скорость растворения 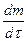 в стационарных условиях описывает уравнение
в стационарных условиях описывает уравнение  ,
,
где 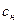 и
и 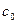 - соответственно концентрация насыщенного раствора у поверхности твердого тела и в объеме раствора,
- соответственно концентрация насыщенного раствора у поверхности твердого тела и в объеме раствора,  - толщина приповерхностного (пограничного) слоя,
- толщина приповерхностного (пограничного) слоя,  - коэффициент массообмена.
- коэффициент массообмена.
В изотермических условиях при постоянных величинах поверхности твердого тела и объема раствора используют константу растворения  . Тогда для скорости растворения можно записать
. Тогда для скорости растворения можно записать  и рассчитать количество вещества
и рассчитать количество вещества  , растворившегося при стационарном процессе за время
, растворившегося при стационарном процессе за время  , по уравнению
, по уравнению
 .
.
Из экспериментальных данных в случае нестационарного процесса растворения константу растворения можно вычислить по уравнению
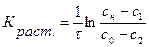 ,
,
где  - время, за которое концентрация раствора изменяется от значения
- время, за которое концентрация раствора изменяется от значения  до значения
до значения 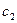 ;
;  - насыщенная концентрация.
- насыщенная концентрация.
Если растворение сопровождается химической реакцией, то закономерности протекания такого процесса определяются соотношением скоростей химической реакции и массообмена на границе раздела фаз. Эффективная константа скорости (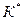 ) вычисляется по соотношению
) вычисляется по соотношению  ,
,
где 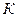 - константа скорости собственно химической реакции (обычно первого порядка),
- константа скорости собственно химической реакции (обычно первого порядка),  - константа скорости диффузии (коэффициент массообмена).
- константа скорости диффузии (коэффициент массообмена).
Для реакций, протекающих в диффузионной области ( ), кинетическое уравнение принимает вид
), кинетическое уравнение принимает вид
 ,
,
где 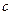 и
и 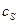 - соответственно концентрации реагента в объеме и у поверхности, на которой происходит взаимодействие.
- соответственно концентрации реагента в объеме и у поверхности, на которой происходит взаимодействие.
Для реакций, протекающих в кинетической области (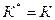 ), концентрация реагента у поверхности равна нулю
), концентрация реагента у поверхности равна нулю 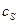 = 0, и кинетическое уравнение принимает вид
= 0, и кинетическое уравнение принимает вид
 .
.
Константа скорости реакции может быть рассчитана по уравнению
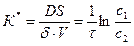 ,
,
где  - время, за которое концентрация снизилась от
- время, за которое концентрация снизилась от  до
до 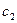 .
.
|
|