
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Её определение
|
|
Существуют различные способы выражения концентрации веществ. Международным союзом теоретической и прикладной химии ИЮПАК их рекомендовано не менее семи, однако в химической кинетике пользуются преимущественно следующими:
1. Молярная концентрация вещества 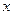 -
- 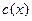 показывает отношение количества вещества
показывает отношение количества вещества 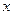 к объему раствора, т.е.
к объему раствора, т.е.  . Размерность молярной концентрации
. Размерность молярной концентрации 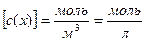 (последнее – устаревшее). Единицей молярной концентрации является
(последнее – устаревшее). Единицей молярной концентрации является 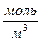 ; размерность
; размерность 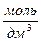 - рекомендуемая для практики дольная единица молярной концентрации. Распространена сокращенная форма записи единицы молярной величины
- рекомендуемая для практики дольная единица молярной концентрации. Распространена сокращенная форма записи единицы молярной величины 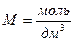 , удобная в использовании. Запись
, удобная в использовании. Запись 
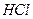 означает децимолярный раствор соляной кислоты. Термин «молярность» использовать не рекомендуется.
означает децимолярный раствор соляной кислоты. Термин «молярность» использовать не рекомендуется.
2. Молярная концентрация эквивалента вещества 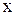 -
- 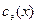 показывает отношение количества вещества эквивалента вещества
показывает отношение количества вещества эквивалента вещества 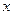 к объему раствора, т.е.
к объему раствора, т.е. 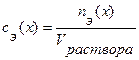 . Размерность молярной концентрации эквивалента вещества
. Размерность молярной концентрации эквивалента вещества 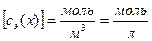 (последнее – устаревшее). Единицей молярной концентрации эквивалента вещества является
(последнее – устаревшее). Единицей молярной концентрации эквивалента вещества является 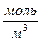 ; размерность
; размерность 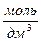 - рекомендуемая для практики дольная единица молярной концентрации. Сокращенная форма записи единицы молярной концентрации эквивалента вещества
- рекомендуемая для практики дольная единица молярной концентрации. Сокращенная форма записи единицы молярной концентрации эквивалента вещества 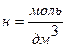 . Термин «нормальность» использовать не рекомендуется.
. Термин «нормальность» использовать не рекомендуется.
Если 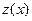 - число эквивалентности вещества
- число эквивалентности вещества 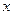 , то
, то 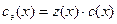 , т.е. молярная концентрация эквивалента вещества в
, т.е. молярная концентрация эквивалента вещества в 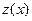 раз больше его молярной концентрации.
раз больше его молярной концентрации.
Существуют различные способы нахождения концентрации раствора, простым в исполнении является объемное титрование, которое широко используется в практикуме по химической кинетике. Вне зависимости от химической сути используемого метода титрования расчет концентрации проводят по з акону эквивалентов, по которому массы реагирующих веществ пропорциональны молярным массам их эквивалентов. Закон можно сформулировать иначе: произведение молярной концентрации эквивалента вещества на объем титруемой пробы раствора в момент эквивалентности равно числу молей эквивалентов вещества титранта, т.е. произведению молярной концентрации эквивалента вещества титранта на объем, пошедший на титрование:
 . (8)
. (8)
Так, для реакции 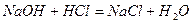 формула (8) примет вид
формула (8) примет вид
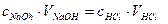 . (9)
. (9)
Концентрация растворов изменяется при разведении, и это нужно обязательно учитывать с помощью формулы
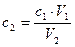 . (10)
. (10)
По внешнему виду она напоминает закон эквивалентов, но вместе с тем, здесь 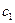 и
и  - концентрация раствора и его объем, взятый для приготовления раствора, который будет использоваться в опыте. Обычно
- концентрация раствора и его объем, взятый для приготовления раствора, который будет использоваться в опыте. Обычно 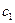 - это та концентрация, которая записана на этикетке емкости с раствором, поэтому иногда её называют «бутылочной». Кроме того, в формуле (10)
- это та концентрация, которая записана на этикетке емкости с раствором, поэтому иногда её называют «бутылочной». Кроме того, в формуле (10) 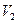 - объем раствора, который готовит студент, и
- объем раствора, который готовит студент, и  - его концентрация.
- его концентрация.
|
|