
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диаграмма состояния CaO-SiO2 .Хар-ка бинарных соединений в этой системе – мета- и ортосиликат Са, трехкальциевый силикат.
|
|
В системе СаО—SiO2 существуют следующие бинарные соединения: однокальциевый силикат (метасиликат кальция) CaO-SiО2 или CaSiO3; трехкальциевый дисиликат 3CaO-2SiO2 или Ca3Si2О7; двухкальциевый силикат (ортосиликат кальция) 2CaO-SiO2 или Ca2Si04; трехкальциевый силикат 3CaO-SiO2 или Ca3Si05.
Метасиликат кальция CaO-SiO2 имеет две полиморфные модификации: низкотемпературную форму β -CaO-SiO2 (волластонит), устойчивую до температуры 1125°С, выше которой она переходит в высокотемпературную форму α -CaO-SiO2 (псевдоволластонит), плавящуюся конгруэнтно при 1544°С.
Трехкальциевый дисиликат 3CaO-2SiO2 плавится инконгруэнтно при 1464°С, разлагаясь на жидкость и кристаллы α -2CaO-SiO2. Имеются данные о существовании двух полиморфных модификаций 3CaO-2SiO2 - ранкинита и низкотемпературной разновидности - килхоанита (на диаграмме не отмечены).
Трехкальциевый силикат 3CaO-SiO2. Это соединение имеет область стабильного существования от 1250 до 2070°С. Ниже температуры 1250°С оно не стабильно и разлагается в твердом состоянии на a'-2CaO-SiO2 и СаО, а при 2070°С плавится инконгруэнтно на жидкость состава: 73, 6% (мас.) СаО и 26, 4% (мас.) SiO2 и кристаллы СаО. Трехкальциевый силикат имеет шесть мало отличающихся друг от друга по своей структуре полиморфных разновидностей, переходы между которыми относятся к полиморфным превращениям со смещением, связанным с изменениями во вторичной координационной сфере.
 Двухкальциевый силикат 2CaO-SiO2 - конгруэнтно плавящееся при 2130 °С соединение, обладающее сложным и до конца не изученным полиморфизмом. Диаграмма состояния однокомпонентной системы 2CaO-SiO2 по Бредигу, в соответствии с которой ортосиликат кальция существует в четырех полиморфных формах: α, α /, β и γ. Три из них энантиотропные, т. е. имеют температурные области стабильного существования: низкотемпературная γ -форма (до 850°С), α '-форма (850-1450°С) и высокотемпературная α -форма (1450-213О°С). Четвертая β -форма при обычном давлении не имеет температурной области стабильного существования, т. е. является метастабильной (ниже 675 °С) и монотропной по отношению к γ -форме. Характер полиморфных превращений в чистых препаратах 2CaO-SiO2 см на схеме: при охлаждении α '-форма сначала переходит в метастабильную β -форму, а последняя в устойчивую при низкой температуре γ -форму. Переход β → γ сопровождается значительным уменьшением плотности и увеличением удельного объема (на ~13%), что приводит к саморассыпанию спеченных препаратов 2CaO-SiO2 . Предотвратить переход можно за счет: 1)термической стабилизации (заключ. в резком охлаждении образцов, при котором β не успевает перейти в γ) Малоэффективно; 2) физическая стаб.(смысл в образовании стекловидной оболочки вокруг С2S при охлаждении системы, содержащей жидкую фазу. Прочная оболочка не позволяет расшириться материалу, капсулируя β -форму; 3)кристаллохимическая (введение добавок (В2О3, оксиды щелочных, переходных металлов), которые в структуре С2S образуют тв. р-ры и не дают структуре изменяться. Самая эффективная стабилизация.
Двухкальциевый силикат 2CaO-SiO2 - конгруэнтно плавящееся при 2130 °С соединение, обладающее сложным и до конца не изученным полиморфизмом. Диаграмма состояния однокомпонентной системы 2CaO-SiO2 по Бредигу, в соответствии с которой ортосиликат кальция существует в четырех полиморфных формах: α, α /, β и γ. Три из них энантиотропные, т. е. имеют температурные области стабильного существования: низкотемпературная γ -форма (до 850°С), α '-форма (850-1450°С) и высокотемпературная α -форма (1450-213О°С). Четвертая β -форма при обычном давлении не имеет температурной области стабильного существования, т. е. является метастабильной (ниже 675 °С) и монотропной по отношению к γ -форме. Характер полиморфных превращений в чистых препаратах 2CaO-SiO2 см на схеме: при охлаждении α '-форма сначала переходит в метастабильную β -форму, а последняя в устойчивую при низкой температуре γ -форму. Переход β → γ сопровождается значительным уменьшением плотности и увеличением удельного объема (на ~13%), что приводит к саморассыпанию спеченных препаратов 2CaO-SiO2 . Предотвратить переход можно за счет: 1)термической стабилизации (заключ. в резком охлаждении образцов, при котором β не успевает перейти в γ) Малоэффективно; 2) физическая стаб.(смысл в образовании стекловидной оболочки вокруг С2S при охлаждении системы, содержащей жидкую фазу. Прочная оболочка не позволяет расшириться материалу, капсулируя β -форму; 3)кристаллохимическая (введение добавок (В2О3, оксиды щелочных, переходных металлов), которые в структуре С2S образуют тв. р-ры и не дают структуре изменяться. Самая эффективная стабилизация.
Применение и св-ва. Значение системы CaO—SiO2 определяется тем, что существующие в ней соединения являются важной составной частью многих технических продуктов — цементов, доломитовых и других огнеупоров, некоторых видов керамики, шлаков черной металлургии и т. д. 3CaO-SiO2 в виде минерала алита представляет собой главный минерал портландцемента, обеспечивает все глвные св-ва цемента; в состав портландцемента входит также β -форма 2CaO-SiO2 в виде минерала белита; β - CaO-SiO2 – основа волластонитовой керамики (высокая стойкость, хор. диэлектрич. св-ва); 3CaO-2SiO2 большого значения не имеет.

|

|
№26.1. Процесс плавления. Структурные изменения в процессе плавления крист. в-в.. Т плавления и факторы, влияющие на нее. Зависимость между Т пл, структурой и энергией крист. решетки. Конгруэнтное и инконгруэнтное плавление. Тугоплавкие в-ва. Плавление стекол, отличие от плавления кристаллов.
Плавление - процесс перехода вещества из твердого состояния в жидкое, совершающийся под действием температуры. Плавление кристаллических веществ является фазовым превращением, обусловленным скачкообразным изменением их внутреннего строения и связанных с ним физико-химических свойств.
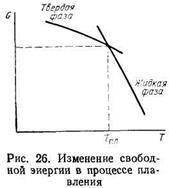 Условием равновесия между твердой и жидкой фазами должно быть равенство GTB=Gж. Графически такое состояние иллюстрирует рис. 26, из которого видно, что при температуре плавления кривые свободной энергии твердой и жидкой фаз пересекаются. Выше температуры плавления устойчиво жидкое состояние, ниже ее — твердое.
Условием равновесия между твердой и жидкой фазами должно быть равенство GTB=Gж. Графически такое состояние иллюстрирует рис. 26, из которого видно, что при температуре плавления кривые свободной энергии твердой и жидкой фаз пересекаются. Выше температуры плавления устойчиво жидкое состояние, ниже ее — твердое.
Плавление — эндотермический процесс, его характеризуют скрытой теплотой плавления, т. е. количеством теплоты, которое необходимо сообщить веществу, нагретому до температуры плавления, чтобы его расплавить. Эта теплота расходуется на преодоление сил взаимодействия атомов кристаллической решетки и характеризует разницу в энергии взаимодействия между частицами в твердом и жидком состояниях.
Температура плавления – равновесная Т, при которой энергии Гиббса твердого тела и жидкости совпадают.
Структурные изменения.
Плавлению в-ва предшествует период структурной подготовки – предплавление. Оно связано с процессом накопления вакансий в материале.
Появление вакансии приводит к необходимости перераспределения сил химической связи между оставшимися ионами, что является причиной возникновения сил отталкивания между катионами и анионами в соответствующих координационных сферах. Это вызывает дополнительное увеличение термического расширения кристалла вблизи температуры плавления, благодаря чему число слабых связей в решетке возрастает и кристалл становится все менее и менее твердым. Из-за склонности вакансий к флуктуационному слиянию при их скоплении образуются поверхности разрыва, отделяющие друг от друга отдельные атомные группировки — микроблоки. Это приводит к тому, что в момент плавления кристалла в расплав переходят не отдельные атомы, а их группировки. Этот процесс разделения структуры на микроблоки с последующим их переходом в расплав наз. процессом кооперативного позиционного разупорядочивания.
Факторы, влияющие на Тпл - внутренние и внешние.
Главный внутр. фактор – характер и энергия кристалл. решетки: с увеличением энергии решетки Тпл возрастает у однотипных в-в.
| MgO | CaO | SrO | BaO | |
| U кр.реш, кДж/моль | ||||
| Тпл. |
Наиболее тугоплавкие соединения образованы решетками с прочными ковалентными связями (графит, алмаз). Решетки с Ван-д-В связями имеют низкую Тпл. Промежуточное положение занимают ионные решетки, причем в кристаллах с ионно-ковалентой связью ↑ степени ковалентности часто приводит к ↓ Тпл.
К внешним факторам прежде всего относится 1) давление. Зависимость Р от Т определяется характером изменения удельного объема при плавлении по ур. Клапейрона-Клаузиуса: dP/dT=Q/T/\V Для большинства в-в, в том числе силикатов, удельный объем (Δ V) при плавлении ↑, т.е. плотность↓. Для таких систем ↑ Р приводит к ↑ Тпл. Для некоторых в-в Δ V при плавлении ↓ (ρ ↑), что приводит к ↓ Тпл при ↑ Р(вода, кремний). 2) Степень дисперсности. С ↑ степени дисперсности, ↓ Тпл. Это заметно для высокодисперсных систем. 3) Наличие примесей. Даже небольшое кол-во примесей способно ↓ Тпл.
Температура плавления определяет тугоплавкость в-ва: Tпл=H/S, Нпл –энтальпия плавления(скрытая теплота плавления); Sпл – энтропия плавления(изменение энтропии). При плавлении энтропия увеличивается. Тугоплакие в-ва должны обладать выс. Нпл и низк. Sпл. Высокая Нпл реализуется при очень высокой энергии связи в решетке (ковалентная, ионная, иногда металл. связь). Малое изменение энтропии реализуется в случае простого механизма структурной перестройки. Когда имеется сравнительно простая структура, единственным механизмом возрастания энтропии при плавлении явл. увеличение степени позиционного разупорядочение без существенного изменения координации атомов. Этим 2 требованиям отвечают в-ва различных классов: оксиды, карбиды, нитриды, многие силикаты с простой структурой (карбид гафнияТпл=4200, нитрид титана=3200).
Конгруэнтное плавление - плавление без разложения с образованием жидкости того же состава; инконгруэнтное – плавление с разложением, образуется жидкость и выделяются кристаллы другого соединения (и ж. и к. отличаются от исходного состава).
Аморфные тела (стекла), в отличие от индивидуальных кристаллов, плавятся в интервале температур. По мере увеличения Т, они размягчаются, вязкость падает и они переходят в расплав. Процесс происходит непрерывно, т.к атомы расположены хаотично, обладают разной энергтей связи.
№26.2. Диаграмма состояния MgO-SiO2. Хар-ка соединений в этой системе – периклаз, мета- и ортосиликаты магния. Их получение, св-ва, распространение в природе и технических продуктах. Природные гидросиликаты магния - тальк, асбест.
Особенности системы: в высококремнеземистых составах системы MgO—SiO2 наблюдается явление ликвации; высокая тугоплавкость составов в этой системе.
В системе существуют два бинарных соединения: ортосиликат магния 2MgO-SiO2 и метасиликат магния MgO-SiO2.
Ортосиликат магния (форстерит) —соединение, не имеющее полиморфных разновидностей, плавится конгруэнтно при 1890°С (пo другим данным при 1860°С). В природе форстерит встречается главным образом в виде твердых растворов с ортосиликатом оксида железа (II)—фаялитом 2FeO-SiO2, называемых оливинами, состав которых отвечает общей формуле (Mg, Fe)2SiО4 Форстерит с фаялитом образуют непрерывный ряд твердых растворов. Эти горные породы, выходя на поверхность, выветриваются, образуя гидросиликаты магния: 3MgO-2SiO2 -2Н2О(асбест); 3MgO-4SiO2 -Н2О(тальк). Эти минералы явл сырьем в производстве форстеритовых, тальковых, стеатитовых огнеупоров. Тальк, стеатит – основа керамики с хор электроизоляционными св-ми, кот превосходят лучшие сорта фарфора. Обладает выс. механ св-ми.
Получают ортосиликат магния: 1) из чистых оксидов при Т=1800 (р-ия); 2) из гидросиликатов магния термическим разложением при более низкой Т=1200. Св-ва: 1) тугоплавкость; 2) выс. хим. стойкость, шлакостойкость; 3) хор. диэлектрич. св-ва; 4) выс. Т деформации под нагрузкой.
Метасиликат магния плавится инконгруэнтно при 1557°С, разлагаясь на жидкость состава 37, 5% (мас.) MgO и 62, 5% (мас.), SiO2 и кристаллы 2MgO-SiО2. В отличие от ортосиликата метасиликат магния имеет три полиморфные разновидности, называемые энстатитом (низкотемперат форма), клиноэнстатитом и протоэнстатитом (высокотемпературные). По некоторым данным протоэнстатита не существует. В природе метасиликат магния встречается чаще всего в виде твердого раствора с FeO-SiO2, входящего в состав распространенных минералов группы пироксенов.
Получают: 1) из чистых оксидов при 1800; 2) разложением гидросиликатов (талька, стеатита) при 1200.
MgO – периклаз, получается: 1) термическим разложением солей магния (карбонатов); 2) термическим разложением гидроксида магния; 3) из морской воды. Св-ва. 1) тугоплавкость (Тпл=2800), при Т> 1800 интенсивно возгоняется; 2) очень стойкий к действию к-т, щелочей, шлаков; 3)большой КТР – низкая термостойкость; 4) способен медленно гидратироваться.
Значение. При обжиге карбоната магния < 1000º C образуется полуаморфный продукт, способный взаимодействовать с водой и затвердевать (основа магнезиальных цементов). При обжиге > 1500 образуется крист. периклаз, кот. не взаимодействует с водой (основа керамики). Высокообжиговый периклаз явл составной частью периклазовых, доломитовых, магннезито-хромитовых огнеупоров.
|
|