
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Динамический и статический методы построения ДС. Последовательность операций при реализации этих методов. Особенности экспериментального построения ДС силикатов.
|
|
Сущность динамического метода построения ДС состоит в построении методом термического анализа кривых охлаждения (или нагревания) образцов в координатах температура- время. Если фазовое превращение сопровождается тепловым эффектом (а практически все фазовые превращения сопровождаются изменением энтальпии системы), то это будет фиксироваться на указанных кривых в зависимости от характера равновесия (числа степеней свободы системы) в виде точки перегиба, отвечающей изменению скорости падения или увеличения температуры (моно-или дивариантное равновесие), или в виде горизонтальных площадок, отвечающих сохранению постоянной температуры образца (инвариантное равновесие).
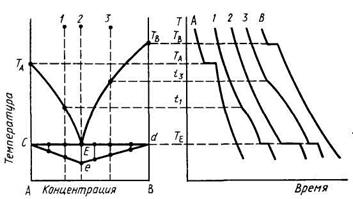
Практически этот метод осуществляется следующим образом (рис.). Для построения, например, диаграммы состояния двухкомпонентной системы А—В термическому анализу подвергаются чистые компоненты А и В и смеси с различным их содержанием (например, составы 1, 2, 3 и т. д.). Для получения кривых охлаждения исследуемые образцы нагревают в печи до полного расплавления, выдерживают при этой температуре для гомогенизации расплава и затем охлаждают, фиксируя температуру образцов. На кривых (А и В) охлаждения чистых компонентов при температурах ТА и Тв появятся горизонтальные площадки, т. е. зафиксируется остановка в падении температуры, соответствующая температуре кристаллизации соответствующего компонента, которая для индивидуальных химических соединений происходит при постоянной температуре (постоянная температура образца при охлаждении поддерживается за счет выделения скрытой теплоты кристаллизации). Такая же остановка на всех кривых охлаждения смесей компонентов А и В появится при эвтектической температуре Те, которой также соответствует инвариантное состояние системы (кривая 2 точно соответствует эвтектическому составу, на кривой охлаждения которого кроме горизонтальной площадки при эвтектической температуре никаких других остановок или перегибов не будет). На кривых охлаждения смесей 1 и 3 при температурах t1 и t3 появится перегиб, т. е. зафиксируется изменение скорости падения температуры, что обусловлено началом кристаллизации компонентов А или В, в ходе которой выделяется теплота кристаллизации. Пересечение горизонталей найденных температур фазовых превращений с вертикалями составов даст точки, принадлежащие кривым ликвидуса. В более сложных системах на кривых охлаждения могут появиться не один, а несколько перегибов или площадок, отвечающих кристаллизации различных твердых фаз или каким-либо другим процессам в системе, кроме плавления или кристаллизации. Эвтектическому составу (2 на рис.) будет соответствовать максимальная по времени остановка температуры, т. е. максимальная длина горизонтальной площадки на кривой охлаждения при эвтектической Т. Откладывая на ДС длины указанных площадок для различных составов в виде перпендикуляров, проведенных к горизонтали эвтектической температуры, можно построить треугольник (cde), высота которого (Ее) определит эвтектический состав.
Этот метод дает искаженные результаты для систем с высокой вязкостью из-за их склонности к переохлаждению. Построение по кривым нагревания дает более достоверные результаты.
Статический метод построения ДС. Принцип метода заключается в фиксации равновесных при данной температуре фаз в системе и последующего определения их состава и содержания в системе. Метод состоит из следующих операций.
Сначала изготовляют смеси компонентов исследуемой системы различного состава. Для лучшей гомогенизации каждую смесь многократно сплавляют или спекают с промежуточным и конечным измельчением в тонкий порошок. Описанная операция называется отжигом. Вторая операция называется закалкой. Образец после выдержки при заданной температуре резко охлаждается. Это достигается сбрасыванием образца из печи в холодную инертную жидкость с хорошей теплопроводностью (например, в воду, ртуть). При резком охлаждении происходит фиксация того состояния, в котором образец находился при температуре выдержки, т. е. кристаллические фазы, если они есть, фиксируются («замораживаются») в таком виде и количестве, в каком они находились при температуре выдержки, а жидкая фаза застывает в стеклообразном состоянии. Третьей операцией является определение состава и содержания фаз в закаленном образце с помощью методов микроскопического, рентгенографического анализов или другими методами.
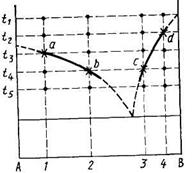
Каждая смесь подвергается закалке от различных температур. Если, например, в смеси состава 1 (рис.), закаленной от температур t1 и t2, обнаружена только стекловидная фаза, то это означает, что кристаллизация расплава при температуре выдержки еще не началась и эта температура лежит выше температуры ликвидуса. Тогда выдерживают эту же смесь при более низкой температуре, например t4. Если в закаленном при этой температуре образце обнаружено большое содержание кристаллической фазы, значит указанная температура лежит ниже температуры ликвидуса. Повторяя аналогичные определения несколько раз и постепенно сужая интервал между температурами t2 и t4, находят ту температуру (t3), которой соответствует появление в образце первых кристаллов твердой фазы. Эта температура будет соответствовать точке а
|
кривой ликвидуса. Проделывая то же самое с другими составами (например, 2, 3, 4), находят другие точка кривых ликвидуса (b, с, d и т. д.).
Метод закалки является чрезвычайно трудоемким. Дело осложняется, если в системе при изменении ее параметров имеют место не только процессы плавления и кристаллизации, но и другие процессы, например полиморфные превращения, образование твердых растворов, образование или распад химических соединений и т. д.
Несмотря на это, статический метод является основным и наиболее точным экспериментальным методом построения ДС силикатных систем. Уменьшить трудоемкость метода позволяет использование высокотемпературной микроскопии и высокотемпературного рентгеновского анализа, позволяющих определять состав и содержание фаз в образце непосредственно при высокой температуре.
Особенности эксперим. построения. Построение реальных ДС сводится к определению опытным путем температур фазовых превращений, характера и состава фаз, находящихся в данной системе в равновесии при различных температурах. Эти исследования производятся различными методами химического и физико-химического анализа — термическим, микроскопическим, электронно-микроскопическим, рентгенографическим, электронографическим, локальным рентгеноспектральным и другими методами анализа. Иногда используют также дилатометрические исследования, изучение электросопротивления, твердости и других свойств материалов. Правильность построения ДС на основе экспериментальных данных контролируется правилом фаз и так называемыми принципами непрерывности и соответствия, сформулированными Н. С. Курнаковым, которым диаграмма не должна противоречить. Принцип непрерывности заключается в том, что при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз и системы в целом изменяются также непрерывно, но при условии, что не изменяется фазовый состав системы, т. е. не возникают новые и не исчезают старые фазы. Принцип соответствия заключается в том, что каждой фазе или совокупности фаз системы, находящейся в равновесии, соответствует на диаграмме определенный геометрический образ — точка, линия, область. Наиболее распространенные экспериментальные методы – динамический и статический.
№25.1. Кремнийорганические соединения. Классификация. Алкилсиланы, алкоксисиланы и силиконы: состав, способы получения, св-ва и применение.
Кремнийорганическими соединениями наз. такие соед, кот. содержат в своем составе одновременно Si и органические радикалы и группы (могут входить и другие элементы). Si-орг. соединения можно разделить на 2 группы: низкомолекулярные и высокомолекулярные.
Низкомолек. Si-орг. соединения - могут быть представлены как производные силанов SinH2n+2, образующиеся путем замещения атомов водорода органическими радикалами и группами(СН3-, С2Н5-, С6Н5-, СН3О-, С2Н5О-). Название строится по след. принципу: если один атом Si в соединении, то указывается число и название радикалов и групп, замещающих атомы водорода, затем – название исходного силана. (С2Н5 )2 SiН2 – диэтилсилан, (С6Н5)3 SiН- трифенилсилан. Если соединение содержит > одного атома Si, то эти атомы нумеруются слева направо и в названии цифрами по порядковой нумерации указывается место атомов Si, в которых произошло замещение водорода. В остальном название строится также как с одним атомом Si.
Алкилсиланы. (органозамещенные силаны).представляют собой соединения, в кот. с Si связаны органические (алкильные) радикалы R. Синтезированы одно-, двух-, трех- и четырехзамещенные силаны - H3SiR, H2SiR2, HSiR3 , SiR4 (известны некоторые соединения типа Si2R6). Органические радикалы R могут быть алифатические и ароматические. Атом Si может быть связан с радикалами того и другого рода одновременно.
Алкилсиланы обычно получают при взаимодействии кремнегалогенов с металлоорганическими соединениями магния, цинка и др. металлов:  (R= СН3, С2Н5 и тд). По аналогичным р-ям могут быть также получены алкилгалогенсиланы – соединения типа RSiН2 Cl, RSiCl3 и тд., содержащие в своем составе органическую группу, Si и галоген.
(R= СН3, С2Н5 и тд). По аналогичным р-ям могут быть также получены алкилгалогенсиланы – соединения типа RSiН2 Cl, RSiCl3 и тд., содержащие в своем составе органическую группу, Si и галоген.
Св-ва. В отличие от кремневодородов алкилсиланы относительно устойчивы: они не воспламеняются на воздухе, не разлагаются водой и не растворяются в ней. В парообразном состоянии в присутствии кислорода и при воздействии пламени они взрываются, образуя SiО2. Чисто алифатические соединения Si представляют собой легко растворимые в органических растворителях жидкости, а чисто ароматические соединения при обычной Т явл. твердыми в-ми и в большинстве случаев хорошо кристаллизуются. Алкоксисиланы (эфиры ортокремниевой кислоты). Эти соединения типа Si(ОR)4 можно рассматривать как производные силана, в котором атомы водорода замещены на оксигруппы (ОR)- , или как производные ортокремниевой к-ты Н4SiО4 , в которой атомы атомы водорода замещены на органические радикалы R. Эфиры ортокремниевой к-ты получают при взаимодействии спиртов и фенолов с кремнегалогенами, например этиловый эфир ортокремниевой к-ты: SiCl4+4C2H5OH=Si(OC2H5)4+4HCl
Характерной особенностью эфиров явл. их способность к гидролизу в воде, а продуктов гидролиза – к конденсации. Эфиры ортокремниевой и поликремниевой к-т применяют в качестве связующих веществ в керам. пром., при изготовлении специальных лаков, для получения особо дисперсного силикагеля. Некоторые аминопроизводные Силанов вследствие их водоотталкивающего действия применяют для пропитки тканей, бумаги, керамических изделий и асфальта, при строительстве дорог.
Наибольшее техническое значение имеют высокомолекулярные Si-орг. соединения – силиконы. Их важнейшими представителями явл. полиоргансилоксаны (силиконы). Силиконы представляют собой Si-орг. соединения, которые содержат различное число групп -Si-, связанных между собой через атомы кислорода. Их можно рассматривать как производные полимерных кремневодородов типа (SiН2 )х, которые образуются путем замещения атомов водорода на органические группы и замешения связей -Si-Si- на связи -Si-О-Si- (силоксанная связь).Названия силиконов с небольшим числом атомов кремния строятся также как и низкомолекулярные, но завершаются обозначением числа атомов Si, связанных через кислород (ди-, три-, тетра- и тд) и словом силоксан.
Силиконы получают при гидролизе мономеров, в частности, алкилгалогенсиланов, эфиров ортокремниевой к-ты и тд. Простейший силикон- гексаметилдисилоксан- можно получить: 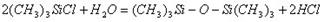
Если исходить из соединения типа SiR2Х2 (R=алкил, Х=галоген), то образуются в-ва, содержащие большее число атомов Si. Реакции гидролиза при получении силиконов обычно протекают в несколько стадий. При этом промежуточной стадией явл. образование силиколей – производных галогенсиланов, в которых атомы галогена замешены на гр. ОН. Гидролиз алкилгалогенов протекает довольно быстро и сопровождается конденсацией образующихся продуктов, что приводит к образованию высокомолекулярных полимеров, содержащих различное кол-во атомов Si. Конденсация происходит при избытке воды, нагревании или при введении спец. катализаторов конденсации. На практике при получении силиконов сначала синтезируют алкилгалогенсиланы из SiСl4, тетраэтилового эфира ортокремниевой к-ты или из элементарного Si. Затем эти соедиения гидролизуют для получения силиколей. При соответствующей обработке (н-р, при нагревании) силиколи конденсируются с образованием силиконов. При этом можно регулировать длину цепей в получаемом силиконе.


Св-ва. В зависимости от степени полимеризации силиконы могут иметь различное агрегатное состояние. Силиконы с небольшим количеством атомов Si в цепи(или чаще в кольце) явл прозрачными легко подвижными жидкостями. Силиконы с большим кол-вом атомов Si содержат длинные разветвленные или не разветвленные (в завис от способа получения) цепи. В зав. от длины цепей силиконы могут быть маслянистыми жидкостями или пастообразными в-ми, или представлять собой каучукоподобные материалы. некоторые силиконы имеют высокую эластичность (силиконовые каучуки), причем они сохраняют это св-во даже при относительно низких Т(до -65º С). При некоторых условиях в структуре силиконов вместо цепей могут образовываться пространственные сетки, аналогичные тем, которые имеются в силикатах с пространственной структурой. Такие трехмерные сетки существуют в искусственных силиконовых смолах. В химическом и термическом отношении силиконы представляют собой довольно устойчивые соединения и поэтому многие из них применяют в качестве химически и термически стойких материалов (силиконовая резина). Особенно широкое применение силиконы находят в качестве электроизоляционных материалов. Применение силиконовых смол для электроизоляции электрических машин позволяет длительно эксплуатировать их при нагреве до 200 º С. Силиконы также применяют для получения прозрачных влагозащитных покрытий. Некоторые силиконы явл превосходным смазочным материалом, вязкость которого мало изменяется при изменении Т(смазочные масла работают от -50до +200 º С). Из силиконовых смол изготавливают стеклотекстолит – слоистый пластик, армированный стеклотканью; их также используют для пропитки строительных р-ров и бетонов на основе цемента, что существенно повышает атмосферостойкость и долговечность этих материалов.
|
|