
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизмы неспецифической резистентности
|
|
Антиинфекционная резистентность организмов вырабатывалась в процессе длительной эволюции и является свойством всей популяции вида однотипно реагировать на внедрение микроорганизмов, используя для их подавления естественно-физиологические факторы антиинфекционной защиты широкого спектра действия.
Тканевые факторы. Среди тканевых факторов антиинфекционной защиты главную роль играют ареактивность клеток, кожа, слизистые оболочки, лимфатические узлы как иммунологические барьеры, фагоциты и нормальные киллеры.
Видовая ареактивность клеток к патогенным микробам и токсинам обусловлена генотипом, который детерминирует образование на поверхности клеток соответствующих рецепторов. При их отсутствии адсорбция и проникновение инфекционного агента или яда в клетку будут невозможны. Генотипическая ареактивность может быть связана также с дефицитом необходимых для микроба веществ или, например, избирательной специфичностью действия микробных ферментов. Клеточная ареактивность является очень стабильным видовым признаком, но может изменяться под действием различных факторов окружающей среды. Так, Л. Пастер показал наличие ареактивности кур к сибирязвенной инфекции, но при погружении их лапок в ледяную воду и резком охлаждении организма зараженные птицы заболевают. В другом классическом опыте И. И. Мечникова была отмечена природная нечувствительность лягушек, черепах, ящериц к столбнячному токсину. Развитие столбняка у пойкилотермных животных достигалось помещением их в термостат и повышением температуры тела.
Кожные покровы и слизистые оболочки обеспечивают невосприимчивость как механические барьеры и вследствие выделения антимикробных веществ широкого диапазона действия (ферментов, кислот, специфических ингибиторов).
Мощным естественным барьером являются лимфатические узлы. Проникшие в них патогенные бактерии вызывают воспалительный процесс, сопровождающийся освобождением из тканей биологически активных веществ, под влиянием которых происходит активация лейкоцитов, скапливающихся вокруг патогенных микробов и препятствующих их распространению в кровоток, подлежащие ткани и внутренние органы. Наряду с этим в очаге воспаления активируется фагоцитарная реакция.
Значение фагоцитоза как фактора неспецифической резистентности организма впервые оценил И. И. Мечников. Клетки, способные осуществлять поглощение и переваривание микробов, он назвал фагоцитами. Среди фагоцитов И. И. Мечников различал микрофаги и макрофаги. К микрофагам были отнесены гранулярные лейкоциты (нейтрофилы, эозинофилы, базофилы), а к макрофагам — моноциты крови, мигрирующие и фиксированные фагоциты тканей (гистиоциты).
Фагоцитарная реакция осуществляется поэтапно. При завершенном фагоцитозе, заканчивающемся разрушением микро6а, различают четыре стадии: 1) приближение фагоцита к микробу (положительный хемотаксис); 2) прилипание фагоцита к микробу; 3) впячивание наружной мембраны фагоцита с последующим образованием фагосомы и ее слияние с лизосомой; 4) инактивация и ферментативное расщепление микроба в фаголизосоме, проявляющиеся набуханием, фрагментацией и лизисом с полной деградацией до аминокислот и низкомолекулярных соединений. Некоторые виды микроорганизмов; особенно вирусы, проявляют большую устойчивость к лизосомным ферментам или даже размножаются внутри фагоцитов (рис. 2). Такой незавершенный вид фагоцитоза чаще наблюдается в нейтрофилах и заканчивается их гибелью или выталкиванием микробов
.. 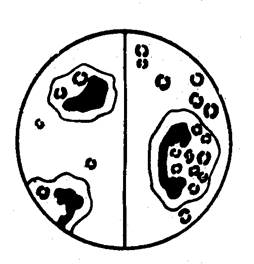
Рис. 2. Незавершенный фагоцитоз
В разрушении микробов, проникших в клетки, активное участие принимают нормальные кцллеры (англ. killer — убийца). Это большие лимфоциты с относительно рыхлым почковидным крупным ядром и обильной цитоплазмой, в которой содержится большое количество цитотоксических веществ. На их внешней мембране имеются специфические рецепторы, благодаря которым нормальные киллеры узнают инфицироанные вирусом или опухолеродные клетки. Связываясь с ними, нормальные киллеры активируются и выбрасывают содержимое своих гранул, которое разрушает их.
Гуморальные факторы. Гуморальные факторы иммунитета, обеспечивающие неспецифическую резистентность организма, очень многочисленны. Большинство из них обладает антимикробной активностью. Концентрация их в крови и лимфе здоровых людей небольшая, но при инфицировании может резко возрастать. Обладают широким спектром действия. Природа гуморальных факторов многообразна, но, как правило, они являются полипептидами. Механизм антимикробного действия многосторонний. Вырабатываются разнообразными клетками, главным о6разом Т-лимфоцитами и макрофагами.
Среди гуморальных факторов антиинфекционной защиты основное значение придают комплементу, пропердину, лизоциму, нормальным антителам, интерферонам I типа.
Комплемент. Структурно сформированного комплемента (лат. complementum — дополнение) как гуморального фактора иммунитета в организме здоровых людей и животных нет. В их крови циркулируют различные фракции комлемента, обозначаемые символами С1, С2, СЗ...С9, В и др. Находясь в дискретном (разобщенном) состоянии, они являются инертными белками — предшественниками комплемента. Сборка (активация) фракций комплемента в единое целое происходит при внедрении в организм болезнетворных микробов. Сформировавшись, комплемент способен лизировать клетки (бактерии, эритроциты) или чаще просто элиминировать генетически чужеродную метку, повышая бактерицидную активность сыворотки крови. О содержании в ней комплемента судят по его гемолитической активности в отношении эритроцитов барана, обработанных сывороткой кролика, содержащей антитела гемолизины. Титр комплемента выражают в минимальном количестве сыворотки, которое в нормальных условиях лизирует 100 % или 50 % оптимально сенсибилизированных гемолизинами эритроцитов.
Содержание комплемента в сыворотках сильно колеблется в зависимости от вида и возраста животных, сезона и даже времени суток. Наиболее постоянный и высокий его титр регистрируется у морских свинок, поэтому именно их сыворотка используется как комплемент для постановки реакции связывания комплемента. У здоровых людей уровень комплемента варьирует незначительно, но у больных может резко повышаться или снижаться.
Система комплемента очень лабильна. Его инактивация происходит в течение 2—4 дней даже при надежном хранении сывороток (5°С). Быстро разрушается комплемент при УФ-облучении, действии солнечного света, протеаз, слабых растворов кислот и щелочей. Исчезает комплементарная активность сывороток после их прогревания при температуре 56°С в течение 29-30 мин.
Пропердин. Защитный белок, состоящий из пяти компонентов. Три из них специфические, а два остальных являются фракциями комплемента. Совместно действуя с комплементом, этот защитный белок тоже разрушает бактерии, усиливает фагоцитарную реакцию и воспалительный процесс.
. Лизоцим. Фермент с молекулярной массой около 15000, нарушающий синтез оболочек бактерий. При частичной утрате оболочек бактерии превращаются в сферобоасты, а при полной в протопласты.. Те и другие быстро погибают или лизируются. Основным источником лизоцимов в крови являются макрофаги. Нормалъные антитела. В сыворотке крови новорожденных могут содержаться антнтитела к различным видам микроорганизмов. По структуре они ничем не отличаются от иммунных, т. е. прио6ретенных в процессе инфекции. Идентичны с ними и по механизму взаимодействия с микробами, т.е. реагируют по закону строгой специфичности. Нормальные антитела экспрессируются на поверхностных мембранах незрелых В-лимфоцитов в виде рецепторов. Будучи цитофильными, в крови новорожденных они обнаруживаются в очень низких титрах, как правило, в цельной сыворотке.
Интерфероны (ИНФ) I типа. Это низкомолекулярные белки, содержащие небольшое количество углеводов (англ. interfere — препятствую размножению). Различают две серологические группы ИНФ I типа — a и b. a-ИНФ — это семейство 20 полипептидов с молекулярной массой около 18 кД. b-ИНФ —гликопротеин с молекулярной массрй 20 кД. Отличаясь по структуре, они обладают одинаковым механизмом действия. В норме a-ИНФ продуцируется мононуклеарными фагоцитами, а b-ИНФ — фи6робластами. Под воздействием инфекционного начала секретируются многими клетками и в месте входных ворот инфекции концентрация ИНФ I типа в считанные часы многократно возрастает. Его защитное действие в отношении вирусов сводится к ингибированию репликации РНКили ДНК. Связавшийся со здоровыми клетками ИНФ I типа защищает их от проникновения вирусов.
Факторы саморегуляции. В основе антиинфекционного иммунитета лежит также способность организма к саморегуляции. Эта форма иммунитета проявляется обычным повышением температуры тела, губительно сказывающихся на жизнедеятельности многих бактерий и особенно вирусов в результате непосредственного влияния или изменения окислительно-восстановительного потенциала и рН пораженных тканей. Большое значение в обеспечении естественного иммунитета имеет выведение микробов и токсинов с мокротой, испражнениями, мочой и другими секретами и экскретами при усилении выделительных функций различных органов и систем. Эти и другие, еще не учтенные факторы и механизмы общефизиологического характера находятся под регулирующим влиянием нейрогуморальных и гормональных функций организма.
| АНТИГЕНЫ КАК ИНДУКТОРЫ ПРИОБРЕТЕННОГО АНТИМИКРОБНОГО ИММУНИТЕТА Приобретенный постинфекционный иммунитет создается в онтогенезе и по наследству не передается. Этот вид иммунитета обусловлен гуморальными и тканевыми факторами высокой специфичности – иммуноглобулинами и иммунокомпетентными клетками. Его образование индуцируется антигенами патогенных микроорганизмов. Общее понятие.Термин антиген (греч. ahti — против и dehex —порождающий антитела) в инфекционной патологии вначале имел буквальное толкование, выражая способность патогенных микробов, продуктов их распада и жизнедеятельности индуцировать в организме образование иммуноглобулинов, которые вступают с ними в специфическую реакцию взаимодействия и обуславливают приобретенный иммунитет. Высокомолекулярные соединения (протеины и протеиды), индуцирующие антителообразование и взаимодействующие с иммуноглобулинами, назвали иммуногенами, а низкомолекулярные (липиды, большинство полисахаридов, анти6иотики, коллоидное железо и многие другие), только реагирующие с антителами, — гаптенами (греч. darto — схватываю).После того как стало известно, что вещества, обладающие антигенными свойствами, являются стимуляторами тканевых факторов приобретенного иммунитета (иммунокомпетентных клеток), термин «антиген» получил научно обоснованную трактовку. В современной иммунологии антигенми называют иммуногены и гаптены, которые, активируя иммунокомпетентные клетки, вызывают образование иммуноглобулинов и развитие многих других иммунологических (защитных) процессов. Природа и свойства иммуногенов и гаптенов. Иммуногенами являются чужеродные белки и их комплексы с липидами и полисахаридами, сложные полисахариды капсул пневмококка, липополисахариды энтеробактерий, нуклеиновые кислоты соматических клеток, многие искусственные высокополимерные соединения. У протеинов иммуногенность, или спосо6ность индуцировать продукцию антител, определяется аминокислотной последовательностью и составом аминокислот (не менее 10). Иммуногенность веществ может быть усилена их конъюгацией с макромолекулами, снижена или утрачена при деструкции. Проявляется иммуногенность белков, как правило, при парентеральном введении. Та часть иммуногена, которая взаимодействует с иммуноглобулином, называется эпитопом или детерминантной группой. В естественных белках-антигенах эпитопом являются аминокислотные остатки. В липопротеидах, гликопротеидах, бромированных, йодированных протеидах белок несет функцию шлеппера (проводника, носителя), или индуктора продукции антител, а гаптен — детерминантной группы. При этом надо представить, что на поверхности антигена может находиться несколько различных детерминантных групп, и в таком случае под его воздействием в организме сформируется соответствующее им по специфичности число видов антител. По происхождению различают антигены микроорганизмов, животных и растений. Антигеиы микроорганизмов. По структуре и составу антигенов разные виды микроорганизмов резко отличаются друг от друга. Лучше всего изучена антигенная мозаика бактерий. В их составе различают соматические O- и Vi-антигены, оболочечные, капсульные (К), жгутиковые (Н), протективные и органоидные. Как правило, все они являются сложными белковыми соединениями. Так, соматическце O- и Vi-антигены содержатся в поверхностных структурах бактериальных клеток и тесно связаны с липополисахаридами. Оболочечные антигены образуются за счет O-антигенов, но в отличие от последних состоят из термолабильных и термостабильных фракций. К-антигены представлены протеиновыми су6станциями (сибироязвенная палочка) или сложными полисахаридами (пневмококк, клебсиеллы). Жгутиковые Н-антигены являются белками, а рибосомальные — нуклепротеидами. Протективные антигены состоят из веществ белковой природы и нуклеиновых кислот. Продуцируются они при выращивании бактерий на специальных искусственных питательных средах, в культурах клеток и тканях организма. Антигенами являются также эндотоксины и экзотоксины. |
По специфичности антигены 6актерий подразделяют на видовые, типовые и гетерогенные. Видовые и особенно типовые отличаются высокой специфичностью. В ответ на их введение в организме животных вырабатываются только такие антитела, которые реагируют с антигенами определенного вида или разновидности микроба. Гетерогенные антигены — это межвидовые антигены, на введение которых вырабатываются групповые антитела, вступающие в реакцию взаимодействия с несколькими видами бактерий.
Аитигены животных. Клетки, взвеси органов и тканей, кровь и сыворотка животных и человека, введенные в организм другого вида (особи, индивидуума), обладают свойствами иммуногенов. Установление этого факта в начале века привлекло внимание врачей к частным вопросам осложнений (анафилаксий), возникающих после введения больным чужеродной иммунной сыворотки или перелитой крови здорового человека. Большой интерес к антигенам животных появился в середине века, когда в 1944 г. П. Медавар доказал иммунологическую природу отторжения трансплантатов нормальных тканей.
Многочисленные виды антигенов животного происхождения условно можно разделить на экзогенные, вводимые извне, и эндогенные — изоантигены (греч. ixox — одинаковый), определяющие индивидуальную специфичность, и аутоантигены (греч. autox — свой), имеющиеся или о6разующиеся в организме.
Экзогенные антигены, такие, как, например, чужеродные белки лечебной (иммунной) сыворотки, вызывают образование антител и активируют клеточные факторы иммунитета независимо от вида и иммуногенности донора.
Природа и антигенные свойства эндогенных антигенов различны. Изоантигены — это собственные специфические белки, углеводы и соединения различных клеток, органов и тканей. Обычно они не антигенны для организма, в котором синтезируются. Эта естественная толерантность (терпимость) к изоантигенам объясняется тем, что в эмбриональном периоде развития плода происходит элиминация (разрушение) всех клонов лимфоидных клеток, способных реагировать с ними.
Среди аутоантигенов различают нормальные (обычные, естественные) и патологические.
Нормальные аутоантигены — это комплексные белки отдельных органов и тканей человека, отделенные от кровотока и иммунокомпетентных клеток гематоэнцефалическим, гематотестикулярным и другими барьерами. К числу таких забарьерных органов относят мозг, семенники, хрусталик глаза, паращитовидные железы. Аутоантигены, забарьерных органов способны распознаваться иммунной системой собственного организма как экзогенные чужеродные белки, но так как в норме они не поступают в кровь, то иммунные лимфоциты и не реагируют с ними. Иммунные реакции с нормальными аутоантигенами чаще всего происходят при травматических повреждениях забарьерных органов или изменении проницаемости барьеров.
Патологические аутоантигены — тоже сложные белки. Возникают в организме при целом ряде инфекционных и соматических заболеваний В результате появляются аутоантитела к собственным клеткам, что приводит к развитию аутоиммунных болезней (тиреоидит, ревматоидны артриты и др.).
Антигены, которые распознаются тимоцитами, называются Т-зависимыми, не распознааощиеся ими — Т-независимыми. Первых намного больше других. Т-зависимые антигены индуцируют разнообразные иммунные процессы, а Т-независимые – только антителообразование.
| ОРГАНЫ ИММУНИТЕТА И ИММУНОКОМПЕТЕНТНЫЁ КЛЕТКИ К органам иммунитета относятся тимус, фабрициевабурса (сумка) птиц и костный мозг у млекопитающих (первичные, или центральные органы), селезенка и диффузно рассеянная или инкапсулированная (лимфоузлы) лимфоидная ткань (вторичные, или периферические, органы). Функционирующей основой всей иммунной системы является сложный комплекс лимфоцитов и макрофагов, располагающийся в клеточно-волокнистой соединительной ткани. Центральными называют те органы, в которых происходит формирование и созревание иммунокомпетентных клеток, а периферическими - органы, где эти клетки затем размножаются и функционируют. Происхождение и формирование иммунокомпетентных клеток. Т-лимфоциты. Происходят из полипотентных стволовых костномозговых клеток. Их дифференциация в Т-лимфоциты индуцируется в тимусе под влиянием тимозина, тимостимулина, тимопоэтинов и других гормонов, которые продуцируются звездчатыми эпителиальными клетками. В процессе созревания у Т-клеток (претимические лимфоциты) постадийно реорганизуется антигенная структура цитомем6ран. Заканчивается дифференциация появлением у зрелых Т-лимфоцитов специфического рецепторного аппарата распознавания антигенов. Образовавшиеся Т-лимфдциты через лимфу и кровь колонизируют тимусзависимые паракортикальные зоны лимфатических узлов или ответствующие зоны лимфоидных фолликулов селезенки. Популяция Т-лимфоцитов очень многочисленна. Больше всего Т-лимфоцитов (Т-клеток) в тимусе и грудном лимфатическом протоке, где они составляют соответственно 95—100 % и 80—90 %; в крови и лимфатических узлах —55—85; в селезенке и лимфоидной ткани слизистых оболочек - 25—40%; в костном мозге Т-клетки практически отсутствуют. |
Характеристика Т-лимфоцитов. Зрелые Т-лимфоциты по форме напоминают малые лимфоциты крови (см. рис. 1). Ядро у них подковоообразное, плотное и интенсивно окрашенное, цитоплазма в виде узкого ободка. Диаметр 6, 0—6, 5 мкм. В сканирующем микроскопе на гладкой поверхности Т-лимфоцитов определяется сравнительно небольшое количество коротких отростков, представляющих собой белковые рецепторы.
Субпопуляции Т-лимфоцитов. По функциональным свойствам популяция Т-лимфоцитов разнородаа. В зависимости от реакций, которые они вызывают, различают Т-киллеры (клетки-убийцы), Т-хелперы (помошники) и Т-супрессоры (регуляторы).
Т-киллеры чаще называются цитотоксическими лимфоцитами, так как они способны разрушать клетки-мишени, в частностй инфицированные вирусами и бактериями, а также злокачественно перерожденные. Повреждение клеток-мишеней Т-киллерами происходит при прямом контакте с ними под действием выделяемого ими лимфотоксина: Т-киллеры являются долгоживущими клетками, очень чувствит6льны к радиации, устойчивы к циклофосфамиду Т-хелперы выполняют посредническую сигнальную функцию, передавая информацию об антигенах. В гуморальном иммунном ответе они реагируют с несущей частью тимусзависимого антигена, индуцируя превращение В-лимфоцитов в плазмоциты. В присутствии хелперов синтез антител увеличивается на один-два порядка. Индуцируют также образование эффекторных Т-лимфоцитов. Т-хелперы — долгоживущие лимфоциты, чувствительны к циклофосфамиду.
Т-супрессоры являются регуляторами антителообразования и других иммунных процессов, участвуют в формировании иммунологической толерантности.
Кроме перечисленных субпопуляций, в состав Т-лимфоцитов входят антигенреактивные клетки, активирующие несенсибилизированные Т-лимфоциты и усиливающие фагоцитоз.
По длительности жизни в популяции Т-лимфоцитов различают две субпопуляции: 1) короткоживущую (несколько дней) оседлую Т1-субпопуляцию, обнаруживаемую преимущественно в тимусе и селезенке, и 2) долгоживущую (месяцы и годы), интенсивно циркулирующую в организме Т2-субпопуляцию. Долгоживущих Т-лимфоцитов в грудном протоке 90 %, в лимфатических узлах — 70 %, в селезенке— 25 %.
В-лимфоципгы. В-клетки (см. рис. 1), так же как и Т-клетки, происходят из стволовых клеток. Созревают они у животных и человека поэтапно — первоначально в костном мозге, а затем в селезенке. Предшественники В-лимфоцитов (В-клетки) появляются на 16-й день внутриутробного развития плода. К моменту рождения, когда происходит их полное созревание, на цитоплазматической мембране В-клеток находятся три иммуноглобулина M, G, D или M, A, D, которые выполняют функцию рецепторов.
Так как большинство антигенов тимусзависимые, то для трансформации зрелых В-лимфоцитов в антителопродуцирующие обычно недостаточно одного антигенного стимула. При попадании таких антигенов В- лимфоциты дифференцируются в плазмоциты с помощью Т-хелперов при участии макрофагов.
Пул В-лимфоцитов в организме животных тоже очень большой. Больше всего их в групповых лимфатических фолликулах, костном крови и селезенке (40—60 %), в лимфатических узлах и грудном лимфатическом протоке (25 %). Практически нет В-лимфоцитов только в тимусе.
Независимо от природы и силы антигена, вызвавшего трансформацию В-лимфоцитов, образовавшиеся плазмоциты продуцируют такие антитела, которые по специфичности аналогичны рецепторным иммуноглобулинам М.
Характеристика В-лимфоцитов. Зрелые В-лимфоциты имеют большие размеры. Их диаметр около 8, 5 мкм. Ядро красится менее интенсивно, а ободок цитоплазмы шире, чем у Т-лимфоцитов. В сканирующем микроскопе поверхность В-лимфоцитов покрыта длинными густыми отростками или, правильнее говоря, огромным количеством антигенраспознающих рецепторов. По структуре рецепторы В-лимфоцитов представляют собой связанные с мембраной мономеры IgM.
Обычно для дифференциации и идентификации В- и Т-лимфоцитов используют тёст розеткообразования с эритроцитами барана. При этом Т-лимфоциты в 85 % случаев, присоединяя 3—5 эритроцитов, образуют розетки, а у В-лимфоцитов таких свойств нет.
Макрофаги как антигенпрезентирующие клетки. Макрофаги — основной тип клеток моноцитарной системы лимфоцитов. Они представляют собой крупные (10—20 мкм), гетерогенные по функциональной активности долгоживущие клетки с хорошо развитой цитоплазмой и лизосомальным аппаратом (см. рис. 1). На их поверхности имеются специфические рецепторы к В- и Т-лимфоцитам, Fc-фрагменту иммуноглобулина, С3-фракции комплемента, гистамину.
Различают подвижные и фиксированные макрофаги. Те и другие дифференцируются из стволовой кроветворной клетки. Значение макрофагов состоит в том, что они накапливают и подвергают переработке проникающие в организм тимусзависимые антигены и презентируют (представляют) их для распознавания Т-клеткам. При определенных условиях они проявляют цитотоксическое действие на опухолевые клетки. Секретируют интерферон, лизоцим, различные фракции комплемента, факторы, дифференцирующие стволовые клетки в гранулоциты, стимулирующие размножение и созревание Т-лимфоцитов.
Таким образом, основными клеточными элементами, обеспечивающими приобретенный иммунитет, являются В-лимфоциты, Т-лимфоциты и макрофаги. При гуморальном типе иммунного ответа эта система иммунокомпетентных клеток функционирует как единое целое в лимфатических узлах, селезенке и многих других вторичных органах иммунитета.
АНТИТЕЛА (ИММУНОГЛОБУЛИНЫ)
Антитела — это особый вид белков, называемых иммуноглобулинами (Ig), который вырабатывается под влиянием антигенов и обладает способностью специфически реагировать с ними. При этом антитела могут нейтрализовать токсины бактерий и вирусы (антитоксины и вируснейтрализующие антитела), осаждать растворимые антигены (преципитины), склеивать корпускулярные антигены (агглютинины), лизировать бактерии, другие клетки, например эритроциты (лизины), повышать фагоцитарную активность лейкоцитов (опсонины), связывать антигены, не вызывая каких-либо видимых реакций (блокирующие антитела).
Структура антител. Электронно-микроскопические исследования показали, что молекула иммуноглобулина имеет форму буквы «игрек». Состоит она из четырех полипептидных цепей, связанных друг с другом дисульфидными мостиками (рис. 3). Две из них длинные и посередине изогнутые, как хоккейные клюшки, а две прямые и почти в 2 раза короче, прилегают снаружи к каждой длинной цепи. Молекулярная масса длинных цепей 50000-70000, коротких - 20000-25000. Ввиду этого длинные полипептидные цепи иммуноглобулина называют тяжелыми или Н-цепями (англ. heavy — тяжелый), а короткие — легкими или Ц-цепями (англ. light — легкий).
 Рис. 3. Строение иммувоглобулина G
Обе цепи иммуноглобулина по порядку расположения в них аминокислот делятся на две части. Одна из них, С-область, у всех цепей иммуноглобулина независимо от их специфичности константна, т.е. имеет одинаковую последовательность аминокислот. Другая — V-область — представляет собой вариабельную часть полипептидных цепей, в которой последовательность расположения аминокислот меняется в зависимости от вида антигена, вызвавшего образование антитела. При этом на концах V-областей молекулы иммуноглобулина, между тяжелыми и легкими цепями, формируются два антигенсвязывающих центра, или как их сейчас называют по механизму взаимодействия с антигеном антидетерминантами или паратопами. Антигенсвязывающие центры иммуноглобулинов имеют зеркальную конфигурацию детерминантной группы того антигена, под воздействием которого вырабатывались. Вследствие этого распознавание антигена соответствующим антителом происходит не по химической структуре, а по общей конфигурации гаптена, благодаря взаимной комплементарности с антигенсвязывающим центром.
Классы. В зависимости от строения константных областей тяжелых цепей все иммуноглобулины разделяют на пять классов:
IgG, IgE, IgD, IgM и IgA (рис. 4).
Рис. 3. Строение иммувоглобулина G
Обе цепи иммуноглобулина по порядку расположения в них аминокислот делятся на две части. Одна из них, С-область, у всех цепей иммуноглобулина независимо от их специфичности константна, т.е. имеет одинаковую последовательность аминокислот. Другая — V-область — представляет собой вариабельную часть полипептидных цепей, в которой последовательность расположения аминокислот меняется в зависимости от вида антигена, вызвавшего образование антитела. При этом на концах V-областей молекулы иммуноглобулина, между тяжелыми и легкими цепями, формируются два антигенсвязывающих центра, или как их сейчас называют по механизму взаимодействия с антигеном антидетерминантами или паратопами. Антигенсвязывающие центры иммуноглобулинов имеют зеркальную конфигурацию детерминантной группы того антигена, под воздействием которого вырабатывались. Вследствие этого распознавание антигена соответствующим антителом происходит не по химической структуре, а по общей конфигурации гаптена, благодаря взаимной комплементарности с антигенсвязывающим центром.
Классы. В зависимости от строения константных областей тяжелых цепей все иммуноглобулины разделяют на пять классов:
IgG, IgE, IgD, IgM и IgA (рис. 4).
 Рис. 4. Классы иммуноглобулинов
Первые три класса иммуноглобулинов являются мономерами, т. е. бивалентными, содержащими два антигенсвязывающих центра: IgM — полимер, состоит из пяти мономерных молекул, связанных в области Fc-фрагментов особыми j -цепями. Валентность IgA различна. В сыворотке крови IgА, как и IgG, имеет мономерную структуру, а в секретах слизистых оболочек, межтканевой жидкости — в виде димеров (двух мономерных молeкул). Эти так называемые секреторные IgAS связаны особым полипептидом, который защищает димеры от воздействия протеолитических ферментов.
Физико-химические свойства Ig. По физико-химическим свойствам иммуноглобулины G, Е, D и А представляют собой белки с молекулярной массой 150000—350000, обозначаемые по константе седиментации как 7S (IgG, IgE, IgD, IgА), 7, 7-8, 0 S (IgА), 9-12 S (IgАS). Макроиммуноглобулины М имеют молекулярную массу 900000 и константу седиментации 19 S.
Биологические свойства Ig. Касаясь биологических свойств иммуно-глобулинов, нужно отметить, что содержание их в крови непостоянно и колеблется от 0, 3-0, 4 мг% (IgЕ) до 50-420 мг% (IgА и IgМ) и 800-1680 мг% (IgG).
На первичное введение в организм антигена вырабатываются IgM. Отличаются они выраженной авидностью (жадностью), т. е., обладая 10 антигенсвязывающими центрами, образуют прочные соединения с антигенами, несущими множественные эпитопы, вызывают агглютинацию и лизис клеток, обеспечивают устойчивость к бактериальным инфекциям.
Сохраняются IgМ, однако, недолго, и период их полувыведения не превышает 5 дней.
При повторном попадании антигена происходит бурная выработка IgG, обеспечивающих нейтрализацию бактериальных токсинов и вирусов. Связываясь с микроорганизмами, IgG активируют образование комплемента, вызывают хемотаксис нейтрофилов. Микрофаги быстро поглощают бактерии, обработанные IgG и комплементом, так как имеют рецептoры к Fс-фрагменту иммуноглобулина и С3-фракции комплемента. IgG легко проникает через барьеры, в частности сквозь плаценту, попадая в кровь новорожденных. В последующем титр их пополняется при кормлении грудью, что обеспечивает иммунитет младенца в первые недели жизни. Период полувыведения IgG равен 24 дням.
Иммуногло6улины А, АS, Е вырабатываются как на первичное, так на вторичное воздействие антигена. При этом сывороточные IgА накапливаются в крови. Секреторные IgАS продуцируются в слизистых оболочках кишечника, верхних дыхательных и мочевыводящих путей, содержатся в глазной жидкости, слюне, молоке и обеспечивают местный иммунитет тканей. Период полувыведения равен 6 дням.
IgE — цитофильный иммуноглобулин, в частности связывается с тучными клетками и базофилами крови. При реагировании с антигенами (микробами, веществами) в результате образования на их поверхности иммунных комплексов высвобождаются медиаторы воспалительной реакции.
Иммуноглобулин класса D находится на поверхности В-лимфоцитов вместе с мономерными IgМ составляет их рецепторы.
Взаимодействие иммуноглобулинов с антигенами. IgG, IgM, IgА реагируют с детерминантами антигенов всеми имеющимися в их молекуле антигенсвязывающими центрами. Вследствие этого в растворах о6разуются крупные конгломераты веществ. Антитела, вызывающие видимые реакции, называют полными. В противоположность этому некоторая часть IgE и IgG реагирует с антигеном лишь одним активным центром, видимых реакций не дает и поэтому называется неполными антителами. Если реакция
взаимодействия этих антител происходит в крови и не вызывает каких-либо нарушений в организме, их называют антителами-свидетелями. Последние блокируют антиген, а нередко одновременно связывают комплемент, вследствие чего называются блокирующими и комплементсвязывающими. Реагирование IgE с антигенами на поверхности клеток приводит к развитию аллергий. При незначительных, бесследно исчезающих проявлениях аллергии на кожных покровах антитела называют реагинами, а при ярко выраженных повреждениях клеток кожи — агрессинами или кожно-сенсибилизцрующими антителами.
ПРОЦЕСС АНТИТЕЛООБРАЗОВАНИЯ
Образование антител как иммунная реакция на антигены происходив в лимфоидной ткани периферических органов иммунитета, главным образом в лимфатических узлах и белой пульпе селезенки. Продуцентами антител являются плазмоциты.
Общая иммунная реакция на антиген. Начинается синтез антител с захвата антигенов макрофагами и появления в корковой зоне лимфатических узлов центров размножения (вторичных фолликулов) с большим количеством митотически делящихся лимфоцитов и плазматических клеток. В первые сутки после введения антигена резко снижается выход лимфоцитов из лимфатических узлов, а в последующие 3—4 дня, наоборот, значительно возрастает и ведет к интенсивной миграции (расселению) стимулированных лимфоцитов через кровь во все лимфоидные ткани и органы.
Фазы антителообразоваиия. В динамике образования антител различают две фазы — индуктивную (латентную) и продуктивную, или репродуктивную.
Индуктивной фазой называют отрезок времени между введение антигена и появлением следов антител или первых плазмоцитов. В этой фазе происходит распознавание антигена. Он фагоцитируется (пиноцтируется) макрофагами или же связывается гастиоцитами. Если вслед за этим антиген полностью разрушается, то антитела не вырабатываются. Антителогенез происходит лишь при частичной деградации антигена. В таком случае в лимфоидной ткани, где происходит связывание антиген отмечаются массовая гибель и параллельно пролиферация клеток, появляется большое количество фагоцитов, увеличивается содержание в ней гистамина, гепарина, серотонина и других веществ, усиливающих воспаление. На фоне воспаления в конце индуктивной фазы начинается кооперация (взаимодействие) между макрофагами, на мембране которых находится измененный антиген, Т- и В-лимфоцитами, в результате чего молодые В-лимфоциты получают сигнал к пролиферации и дифференцируются в плазмоциты.
Индуктивная фаза длится примерно 20 ч. Она очень лабильна. Начавшийся процесс антителообразования в этой фазе можно приостановить воздействием неблагоприятных для организма факторов. Наиболее легко это удается с помощью радиации, вследствие чего индуктивную фазу антителогенеза называют радиочувствительной.
В продуктивной фазе происходит интенсивный синтез антител. остановить его нельзя даже облучением и поэтому продуктивную фазу можно назвать радиорезистентной. В этой фазе иммунного ответа кооперация иммунокомпетентных клеток, темп деления В-лимфоцитов резко усиливаются. В частности, на смену молодым клеткам типа плазмобластов (иммунобластов) в лимфоидной ткани появляются вначале юные, а затем зрелые плазматические клетки. При первичном иммунном ответе максимальное количество плазмоцитов в селезенке и лимфатических узлах появляется на седьмые сутки. Это совпадает с самым высоким титром антител в крови. Повторное введение чужеродного антигена сопровождается необычно интенсивным процессом антителообразования. При этом плазмоциты появляются через 48 ч, а максимальный титр антител — на 3-4-есутки. Это связано с наличием у иммунизированных индивидуумов специальных клеток иммунологической памяти, которые являются, по сути, юными плазмоцитами с незаконченным циклом трансформации. Естественно, что при повторном воздействии антигена они, проделав несколько делений, в считанные часы превращаются в зрелые плазмоциты.
Продуктивная фаза антителообразования сравнительно непродолжительна. Применительно к одному клону она длится около 10 суток, но по отношению ко многим из них может увеличиться до нескольких недель, однако через 2—3 месяца титр антител в крови переболевших инфекционными заболеваниями резко снижается.
Функциональные особенности плазмоцитов. Касаясь функциональных особенностей плазмоцитов, следует подчеркнуть, что они могут рассматриваться как своеобразные одноклеточные 6елковые железы. Как правило, плазмоциты образуют антитела одной иммунологической специфичности, например Н- или О-антитела к соответствующим жгутиковым и соматическим антигенам бактерий, Более того, при наличии в молекуле антигена двух разных детерминант плазмоцит вырабатывает антитела против одной из них. Только 0, 01 % плазмоцитов продуцирует оба антитела. Первичный иммунологический ответ о6ычно начинается с синтеза IgМ. При вторичном ответе на антиген образуются микроглобулины IgG. Развитие клона плазмоцитов, начиная от плазмобласта до зрелой формы, занимает 5—6 суток. Жизненный цикл плазмоцитов, продуцирующих тот или иной вид антител, не превышает 48 ч. При этом вырабатывающиеся клоном плазмоцитов антитела представляют собой широкий спектр иммуноглобулинов, отличающихся по специфичности к различным детерминантам антигена.
АЛЛЕРГИЯ (ГИПЕРЧУВСТВИТЕЛЬНОСТЬ)
Под аллергией понимают неадекватный по силе иммунный ответ организма на определенное вещество-агент (аллерген), связанный с повышенной к нему чувствительностью (гиперчувствительностью). Аллергия специфична и возникает при повторном контакте с аллергеном, вызвавшим изменение иммунореактивности организма. Аллергия свойственна теплокровным животным и особенно человеку. Ее формирование в большей мере обусловлено способностью млекопитающих вырабатывать аллергические (анафилактические) IgЕ.
Природа и классификация аллергенов. Аллергию вызывают многочисленные факторы окружающей среды, но чаще всего химические вещества, обладающие свойствами иммуногенов и гаптенов. По резервуару их образования все аллергены делят на экзоаллергены, попадающи извне, и эндоаллергены, образующиеся в самом организме. Экзоаллергены, с которыми контактирует человек, в свою очередь подразделяют на аллергены неинфекционного и инфекционного происхождения. Среди неинфекционных аллергенов различают бытовые, эпидермальные (перхоть, шерсть, волосы), лекарственные (пенициллин, сульфаниламиды и др.), промышленные (формалин, бензол), пищевые. Отдельно выделяют поллинозы, вызываемые цветочной пыльцой растений (лат: ро11еп -пыльца). Наиболее сильными сенсибилизирующими свойствами среди аллергенов инфекционного происхождения обладают аллергены патогенных грибков, бактерий и вирусов.
Типы аллергических реакций. Аллергии — это иммунные гуморально-клеточные реакции сенсибилизированного организма на повторное воздействиё аллергенов. В настоящее время различают реакции гиперчувствительности немедленного типа (ГНТ) и реакции гиперчувствительности замедленного типа (ГЗТ). К ГНТ относят анафилактический шок, сывороточную болезнь, бронхиальную астму, сенную лихорадку, крапивницу, непереносимость к пищевым и лекарственным веществам. Столь же многочисленна группа реакций ГЗТ. К этой категории гиперчувствительности, в частности, относят инфекционную аллергию на бактерии, вирусы и грибы; аллергию на антибиотики и химические вещества; воспалительные реакции при отторжении трансплантата.
Механизм и общая характеристика реакций ГНТ. В основе возникновения реакций ГНТ лежит процесс взаимодействия между IgE и аллергеном. При этом нужно иметь в виду, что молекулы IgЕ фиксированы на тучных и других клетках тканей, базофилах крови, а у сенсибилизированных лиц (особей) они в большом количестве обнаруживаются в крови.
В развитии ГНТ различают три фазы: иммунологическую, патохимическую и патофизиологическую.
В иммунологической фазе аллерген реагирует с цитофильными и свободноплавающими в крови и межтканевой жидкости антителами.
В патохим.ической. фазе, наступающей вслед за образованием иммунных комплексов на внешних мембранах туч»ых клеток и базофилов, высвобождаются биологически активные вещества, которые повышают проницаемость капилляров и слизистых оболочек, способствуют всасыванию аллергенов и развитию 6ыстрой воспалительной реакции. Реагирование аллергенов со свободноплавающими IgЕ (по старой терминологии - с анафилаксинами) сопровождается 6ыстрsм связыванием комплемента, изменением коллоидного состава и свертываемости крови.
В патофизиологической фазе при различных реакциях ГНТ отмечаются отек слизистых оболочек, покраснение и зуд кожных покровов (крапивница, сенная лихорадка), удушье в результате спазма гладкой мускулатуры бронхов (астма), припухлость и болезненность суставов (сывороточная болезнь), другие местные воспалительные реакции, а при резких нарушениях деятельности сердечно-сосудистой системы —внезапно возникающий анафилактичесуий шок.
Реакции ГНТ проявляются в ближайшие 15 —20 мин после воздействия специфического аллергена; вызываются аллергенами антигенной и неантигенной природы; являются следствием взаимодействия аллергенов с аллергическими антителами. Реакции передаются пассивным путем, посредством введения сывороток сенсибилизированных животных. В 6ольшинстве случаев состояние гиперчувствительности к аллергену можно легко снять путем десенси6илизации.
Механизм и общая характеристика реакций ГЗТ. Реакции ГЗТ обусловлены взаимодействием Т-лимфоцитов с соответствующим аллергеном. В развитии ГЗТ выделяют те же три фазы реакции. В иммунологической фазе аллерген реагирует с неиммунными лимфоцитами, которые в результате бласттрансформации превращаются в зрелые эффекторные тимоциты, способные узнавать «свой» аллерген. В патохимической фазе сенсибилизированные лимфоциты выделяют лимфотоксины, факторы, которые обусловливают хемотаксис и усиливают фагоцитоз, защищают фагоциты от повреждения и ингибируют миграцию макрофагов и др.
Патофизиологическая фаза проявляется выраженной реакцией воспаления в разных тканях и органах.
Реакции ГЗТ развиваются в течение многих часов или нескольких суток после контакта с аллергеном; вызываются после длительного воздействия инфекционных аллергенов и химических веществ; протекают в самых разнообразных тканях с явлением, альтерации (повреждения) клеток сенсибилизированными лимфоцитами; пассивная передача сыворотками сенсибилизированных животных невозможна и достигается введением взвеси Т-лимфоцитов; десенсибилизировать ГЗТ, как правило, не удается.
В заключение следует подчеркнуть, что провести резкую грань между реакциями ГНТ и ГЗТ невозможно. Вначале, по-видимому, формируется ГЗТ как Т-клеточная реакция организма на аллерген, а после выработки иммуноглобулинов проявляется в виде ГНТ. Возможно, обе реакции развиваются параллельно и независимо одна от другой. В ответ на повторное воздействие аллергена у разных животных возникает то ГНТ, то ГЗТ либо обе реакции гиперчувствительности одновременно.
ПАТОГЕНЕЗ И ХАРАКТЕР ПРОЯВЛЕНИЯ
АНАФИЛАКСИИ И ИНФЕКЦИОННОЙ АЛЛЕРГИИ
В возникновении различных типов аллергий ведущее значение принадлежит индивидуальной иммунной реактивности организма человека Однако есть аллергии, доминирующую роль в развитии которых играет характер аллергена. К ним относят анафилактический шок и инфекционную аллергию.
Анафилаксия. Анафилаксия (греч. aha — обратное и jilakziz —действие или беззащитность) представляет собой реакцию гиперчувствительности немедленного типа, которая чаще всего возникает при повторном парентеральном введении чужеродной сыворотки или пенициллина.
Виды анафилаксии. По признаку генерализации различают общую и местную анафилаксии, а по способу приобретения — активную и пассивную. Общая анафилаксия проявляется как системная реакция, нарушающая жизнедеятельность всего организма, а местная — как локальная, ограниченная определенным участком кожи, ткани, органа. Активная анафилаксия является следствием выработки антител под влиянием аллергена, а пассивная — результатом пассивной передачи иммунных сывороток (иммуноглобулинов) от сенсибилизированных до норов.
Характеристика и проявление анафилактического шока. Самой тяжелой формой о6щей анафилаксии является анафилактический шок. Легче всего его вызвать у морских свинок, сенсибилизируя их лошадиной сывороткой. Вводят ее подкожно, внутрибрюшинно, внутривенно. Отмечено, что сенсибилизация животных происходит тем быстрее, чем меньше доза антигена. Эффективным является даже 0, 000001 мл сыворотки. Готовность животных отвечать анафилактическим шоком возникает спустя 9—12 дней инкубации и совпадает с моментом появления антител в крови. Реализуется шок при соблюдении двух условий: 1) повторная или разрешающая доза сыворотки должна превышать сенсибилизирующую в 10—100 раз и быть не меньше 0, 1 мл; 2) для развития шока разрешающую дозу антигена необходимо вводить в кровоток (внутривенно или внутрисердечно).
У морской свинки при возникновении анафилактического шока вначале появляются возбуждение, одышка, затрудненное дыхание, далее, после конвульсивных прыжков, животное падает и погибает, выделяя кал и мочу. При вскрытии павших животных отмечаются резкая эмфизема легких вследствие спазма гладкой мускулатуры бронхов, кровоизлияния в слизистые и серозные оболочки. У человека при возникновении анафилактического шока учащается пульс, повышается температура, возникает одышка, появляются судороги, отеки, боли в суставах, высыпания, резко нарушается деятельность сердечно-сосудистой системы. Смерть анафилаксии наступает редко.
В патогенезе анафилактического шока различают обычные для аллергической реакции ГНТ три стадии.
Местная анафилаксия возникает в коже, подкожной клетчатке и в органах при многократных инъекциях чужеродной сыворотки. При этом развивается гиперергическое воспаление с резко выраженным отеком и квоизлиянием в ткани, заканчивающееся их некрозом. Впервые активный тип гиперергической реакции с образованием глу6оких незаживающих язв в коже и подкожной клетчатке описал Н. Артюс у кроликов, которым 5—7 раз через 5 — 6 дней подкожно вводили лошадиную сыворотку. Феномен Артюса сравнительно легко передается пассивно путем парентерального введения сыворотки сенсибилизированного донора с последующей подкожной инъекцией реципиенту разрешающей дозы сыворотки. В основе развития местной анафилаксии лежит альтерация клеток иммунными преципитатами, связывающими комплемент.
Пассивная анафилаксия — это передача интактному животному состояния анафилаксии посредством введения сыворотки сенсибилизированного донора. Сенсибилизированный реципиент через несколько часов после фиксации в его тканях антител приобретает способность реагировать на введение соответствующего аллергена анафилактический шоком или местной анафилаксией. Пассивно переданная гиперчувствительность к аллергену сохраняется в организме морской свинки от 3—4 недель до 2 месяцев и полностью исчезает после разрушения введенных антител.
Инфекционная аллергия. Развитие инфекционной аллергии и природу ее иммунологической сущности описал Р. Кох. Повторно заражая морскую свинку микобактериями туберкулеза, он обнаружил необычно бурную на них реакцию больного животного. На месте подкожного введения суперинфицирующей дозы в считанные дни возникала язва и вместе с некротической тканью удалялись бактерии туберкулеза, что предупреждало их, распространение в регионарные лимфатические узлы и через кровь — во внутренние органы свинки.
Подобное состояние гиперчувствительности характерно для многих инфекционных заболеваний, но интенсивность проявления этой аллергической реакции не имеет столь яркого характера, как при туберкулезе. Этот тип ГЗТ выявляют с помощью диагностических проб, в которых используются аллергены. Готовятся они из фильтратов бульонных культур, взвесей убитых микроорганизмов или их экстрактов. Вводят аллергены в организм человека накожно или внутрикожно. Накожныё пробы проводят с помощью скарификатора, которым через каплю аллергена, нанесенную в нижней трети предплечья, делают две параллельные поверхностные насечки кожи длиной 5 мм, избегая повреждения сосудов и появления крови. Внутрикожно аллерген вводится туберкулиновым шприцем в количестве 0, 05—0, 1 мл.
Следует подчеркнуть, что скарификационные пробы более специфичны, чем внутрикожные, но последние во стократ чувствительнее первых. При положительных реакциях на месте введения аллергена спустя 24 - 48 ч возникает инфильтрат, состоящий преимущественно из лимфоцитов моноцитов и макрофагов, что визуально проявляется покраснением и припухлостью диаметром более 10 мм.
Оценивая аллергические пробы, нео6ходимо учитывать возможность получения ложноположительных реакций у людей с повышенной чувствительностью кожи или же из-за из6ыточного введения аллергена и нарушения техники их производства. Положительные, но не диагностические аллергические пробы могут регистрироваться у привитых лиц (поствакцинальные), переболевших (анамнестические) или же у больных другим инфекционным заболеванием, возбудитель которого имеет сходные групповые аллергены. В о6щем говоря, положительные аллергические пробы свидетельствуют об инфицированности людей. С учетом этих оговорок они нашли широкое применение в экспресс-диагностике туберкулеза и микобактериозов, лепры, бруцеллеза, туляремии, сапа, актиномикоза, токсоплазмоза, дерматомикозов и др.
ИММУНОПРОФИЛАКТИКА И ИММУНОТЕРАПИЯ
ВАКЦИНЫ
Вакцины — это биологические препараты, предназначенные для создания у людей, животных и птиц иммунитета к инфекционным заболеваниям или реже — к ядам. Имеются корпускулярные и некорпускулярные вакцины. Корпускулярные вакцины содержат аттенуированные (осла6ленные) или убитые микро6ы, некорпускулярные — продукты их химического расщепления (химические вакцины), о6езврежениые экзотоксины бактерий или яды животного и растительного происхождения (анатоксины). По числу антигенов, входящих в вакцину, различают моно- и поливакцины (ассоциированные), по видовому составу – бактериальные, риккетсиозные, вирусные.
Живые вакцины - это, как правило, моновакцины. Одни из них содержат ослабленные бактерии (бруцеллезная, туляремийная, чумная, сибироязвенная, туберкулезная вакцины), другие — вирусы (против натуральной оспы, желтой лихорадки, 6ешенства, полиомиелита, кори, эпидемического паротита). Живые вакцины наиболее иммуногенны и обычно создают напряженный и длительный иммунитет, вследствие того, что измененные штаммы (мутанты) сохраняют свойство размножаться (репродуцироваться) в привитом организме, вызывая миниатюрную вакцинную инфекцию, сжатую в сроках течения и сглаженную по тяжести проявления. Например, противооспенная и туляремийная вакцины обеспечивают устойчивость на протяжении 5—7 лет. Исключение составляет, пожалуй, только антигриппозная вакцина, создающая выраженный иммунитет на 6-8месяцев. К недостаткам живых вакцин относится то, что они очень, реактогенны (энцефалитогенны), обладают аллерргическими свойствами, за счет остаточной вирулентности могут вызывать серьезные осложнения, вплоть до генерализации вакцинного процесса и развития менингоэнцефалита.
Убитые вакцины (брюшнотифозная, паратифозная А и В, дизентерийная, холерная, коклюшная, лептоспирозная, сыпнотифозная, против гриппа, полиомиелита, клещевого энцефалита) используются в виде моно- и поливакцин. Некоторые из них (лептоспирозная, антигриппозная), лючающие несколько разновидностей (сероваров) возбудителя, называются поливалентными. Убитые вакцины слабоиммуногенны и создают непродолжительнЬш иммунитет сроком до года, по-видимому, потому, что в процессе их изготовления происходит денатурация антигенов.
Химцческие вакцины — это препараты, состоящие из полных антигенов микробных культур и очищенные от балластных веществ. Применяются для профилактики брюшного тифа, паратифов А и В (вакцина TABte со столбнячным анатоксином), коклюша, туберкулеза. Разрабатывается метод получения вакцин из протективных антигенов и рибосом. Реактогенность хорошо очищенных вакцин незначительна. По профилактической эффективности химические вакцины превосходят убитые корпускулярные.
Анатоксины (столбнячный, дифтерийный, гангренозные, ботулинический, стафилококковый) относительно мало реактогенны, создают напряженный и длительный иммунитет до 4-5 лет и более.
В настоящее время в арсенале средств борьбы с инфекционными (заболеваниями насчитывается около 30 вакцинальных препаратов против бактериальных, вирусных, риккетсиозных инфекций.
Общая характеристика вакцин будущего. Синтетические вакцины — безбалластные вакцины, содержащие естественные или искусственно синтезированные микробные (вирусные) протективные антигены, не обладающие побочным токсическим действием. Для усиления иммунного ответа они конъюгируются со специально подобранными Т-зависимыми носителями и введены в адъюванты (иммуномодуляторы), которые стимулируют образование высоких титров антител.
Рекомбинантные вакцины — искусственно созданные вакцины, содержащие рекомбинантные вирусы или микробы-химеры, в геномы которых введены гены других микробных видов, кодирующие один или несколько специфических антигенов. Таким путем, в частности, уже создан, рекомбинантный вирус оспенной вакцины, синтезирующий поверхностный HBs-антиген вируса гепатита В; кодирующий гемагглютинин вирус гриппа А; гликопротеины вирусов простого герпеса и везикулярного стоматита. Экспрессия HBs-антигена осуществлена также в дрожжевых клетках, отличающихся необычайно высокой иммуногенностью и полной безвредностью.
Цели применения. Вакцины предназначаются для создания активного индивидуального и коллективного иммунитета. Чаще всего они используются для профилактики инфекционных заболеваний, реже для лечения (гонококковая, стафилококковая, спиртовая дизентерийная вакцины, Vi - антиген брюшнотифозной палочки, бруцеллезная вакцина).
Способы изготовления. Для получения вакцин применяют физические, химические, биологические факторы. Живые вакцины обычно получают, пассируя патогенные микробы через организм невосприимчивых животных, куриный эмбрион, культуры клеток, добиваясь резкого снижения вирулентности. Убитые бактериальные вакцины гртовят по методу Колле, для чего микробы выращивают на плотных средах, смывают, стандартизируют, обезвреживают нагреванием (гретые вакцины) или воздействием химических соединений (формолвакцины, фенолвакцины, ацетоновые и т. п.). Анатоксины получают по методу Рамона, который для детоксикации бактериальных экзотоксинов предложил прибавлять к ним 0, 3—0, 8 % формалина с последующим выдерживанием на протяжении 3—4 недель при температуре 37—42 " С.
Пути введения вакцин. Вакцины вводят в организм накожно, внутрикожно, подкожно, через рот и нос. В последние годы широкое распространение получил метод массовой вакцинации с помощью безыгольных, инъекторов. С той же целью разрабатывается аэрогенный способ одновременной аппликации вакцины на слизистые оболочки верхних дыхательных путей, глаз и носоглотки.
Схема вакцинации. Живые вакцины, кроме полиомиелитной, применяются однократно, убитые корпускулярные, химические вакцины и анатоксиньг вводятся два-три раза с интервалами от 7—10 до 25-40 дней. Ввиду того что многократная вакцинация не обеспечивает высокого охвата населения прививками, применяются депо-вакцины. В качестве депонирующих веществ используют минеральные коллоиды, чаще всего гели гидроксида или фосфата алюминия, масла, которые как адсорбенты обеспечивают постепенное длительное воздействие антигенов на организм, а некоторые на них, например сложные адъюванты типа Фрейнда, неспецифически стимулируют антителогенез.
Плановые прививки. Вакцинацию проводят в плановом порядке и по эпидемическим показаниям (при возникновении заболеваний). Проведение прививок регулируется государственными законами и является общественной мерой борьбы с инфекциями. В настоящее время принят четкая программа иммунизации детей. На первом году жизни ребенка прививают против туберкулеза (в роддоме на 5-7-й день), полиомиелита (в 3 мес.), коклюша, дифтерии и столбняка (в 4 — 5 мес.), а по достиженм года иммунизируют антикоревой вакциной.
ИММУННЫЕ СЫВОРОТКИ (ГАММА-ГЛОБУЛИНЫ)
Сывотортка – жидкая часть крови, лишенная фибриогена. Она образуется при свертывании крови и отделении плазмы от сгустка и форменных элементов.
Классификация. Сыворотки бывают нормальные и иммунные с повышенным титром иммуноглобулинов; гомологичные, полученные от человека, и гетерологичные, или чужеродные, полученные от специально иммунизированныx животных. Иммунные сыворотки по целевому назначению подразделяют на лечебно-профилактические и диагностические, а по характеру содержащихся в них антител — на антитоксические и антимикробные.
Диагностические сыворотки, как уже было сказано, используются для идентификации патогенных микробов. С помощью лечебно-профилактических сывороток создается пассивный иммунитет. Надобность в нем возникает при инфицировании (серопрофилактика) или заболевании (серотерапия).
Антитоксические сыворотки нейтрализуют бактериальные экзотоксины и применяются для лечения и профилактики токсинемических инфекций. К ним относятся противодифтерийная, противостолбнячная, антистафилококковая, против анаэробной инфекции, противоботулиническая сыворотки.
Антимикробные сыворотки обезвреживают бактерии и вирусы. Лучшими из них являются вируснейтрализующие сыворотки, в частности антикоревая, противооспенная, антирабическая, противоэнцефалитная, противополиомиелитная и противогриппозная. Лечебно-профилактическая эффективность антибактериальных сывороток низка, они используются главным образом для профилактикй коклюша и лечения чумы, сибирской язвы, лептоспироза.
Титрование антитоксических лечебных сывороток. Антитоксические сыворотки титруются в антитоксических или международных единицах (AЕ или МЕ). За 1 АЕ принимают минимальное количество сыворотки, предохраняющее определенный вид животных от гибели при заражений специально подобранной дозой токсина. Так, 1 АЕ антидифтерийной сыворотки — это наименьшее количество сыворотки, которое на протяжении 4 суток предохраняет от смерти морскую свинку массой 250 г, инфицированную 100 ДLМ дифтерийного токсина.
Антибактериальные и антивирусные сыворотки не титруются и вводятся по клиническим показаниям в миллилитрах. При определении их лечебной дозы учитываются тяжесть, день заболевания и возраст больного.
Методы получения сыворотки. Лечебные и профилактические гетерологичные сыворотки получают путем иммунизации лошадей, поскольку эти животные более реактогенны, чем другие, и дают большой выход антител. Кроме того, лошадиный белок наименее анафилактогенен. Для получения антитоксических сывороток лошадей вначале иммунизируют анатоксином, а после создания базисного иммунитета — возрастающим дозами токсина. Антибактериальные сыворотки получают путем введения животным убитых или живых микробов.
Нередко для лечения и профилактики инфекционных болезней используются гомологичные сыворотки здоровых доноров, пере6олевших людей или препараты плацентарной крови.
Гамма-глобулины. В целях концентрации иммуногло6улинов, снижения токсичности и уменьшения аллергического действия сыворотки освобождают от балластных белков. При этом используют методы фракционирования сывороток с помощью спирто-водных смесей при температуре 0 " С, ультрацентрифугирования, электрофореза, ферментативного гидролиза (метод диаферм). Очищенные и концентрированные препараты гамма-глобулиновой фракции сывороточных 6елков, содержащие высокие титры антител, называют иммуноглобулинами, а в практике - гамма-глобулинами. В сравнении с нативной сывороткой они более авидны, быстрее реагируют и прочно связываются с антигеном. Применение гамма-гло6улинов снизило количество и тяжесть осложнений, возникающих при введении гетерологичных сывороток. Важно и то, что современная технология изготовления человеческого гамма-глобулина гарантирует полную ги6ель вирусов гепатита.
Способы введения. Сыворотки и гамма-гло6улины вводят в организм различными путями: подкожно, внутримышечно, внутривенно или в спинномозговой канал. После введения иммунной сыворотки пассивный иммунитет возникает спустя несколько часов и продолжается 8—15 дней..
Специфическая десенсибилизация (гипосенсибилизация) анафилаксий. У сенсибилизированных чужеродной сывороткой животных анафилактическое состояние сохраняется в течение многих месяцев, а у человека — практически всю жизнь. В целях предупреждения анафилаксий у человека А. М. Безредка предложил вводить сыворотку небольшими дозами многократно, постепенно связывая анафилактические антитела Этот способ профилактики анафилактического шока называют специфической десенсибилизацией. Проводя ее, предварительно определяют чувствительность организма к белку. С этой целью в сгибательную поверхность предплечья внутрикожно вводят 0, 1 мл чужеродной сыворотки разведенной 1: 100. При отрицательной реакции, проявляющейся с образованием папулы диаметром 9 мм с небольшим ободком покраснения, через 20—30 мин поочередно вводят 0, 1 мл и 0, 2 мл цельной сыворотки, а спустя 1 —1, 5 ч всю остальную дозу. При положительной внутрикожной пробе с инфильтратом более 10 мм десенсибилизация вначале проводится разведенной 1: 100 сывороткой в дозах 0, 5, 1, 0, 2, 0, 5 мл с интервалами в 20 мин, а затем с теми же промежутками 3 раза цельной — 0, 1, 0, 2, оставшийся объем. Состояние десенсибилизации непродолжитёльно и через 5—14 дней вновь появляется исходная гиперчувствительность.
Гомологичные сыворотки (сыворотки человека) анафилактических реакций не вызывают. При нео6ходимости лечебную дозу этих сывороток вводят одновременно. Так, гамма-глобулин из сыворотки человек для профилактики кори вводят внутримышечно в количествё 1, 5—З мл., Для лечения и профилактики инфекционных заболеваний сыворотки и гамма-глобулины должны вводиться как можно раньше после заражения или заболевания. Например, противостолбнячную сыворотку следует использовать в первые 12 ч от момента ранения, а противодифтерийную — не позднее 2-4 ч после постановки диагноза.
СЕРОЛОГОЧЕСКИЕ РЕАКЦИИ ИММУНИТЕТА
Серологическими называют такие реакции, для постановки которых используют сыворотку (serum), содержащую антитела.
Серологические реакции применяют: а) для идентификации микроорганизмов, токсинов, любого другого антигена с помощью известного антитела (иммунная диагностическая сыворотка); б) для определения природы антитела в сыворотке крови с помощью известного антигена (диагностикум).
Основными серологическими реакциями являются реакции агглютинации, преципитации, связывания комплемента, иммунофлюоресценции, нейтрализации вирусов на культурах клеток, куриных эмбрионов и животных, реакция торможения гемагглютинации.
Общие закономерности серологических реакций: 1) реакции ставятся in vitro; 2) проявляются при иммунологическом соответствии (гомологичности) антигена и антитела, в оптимальных температурных условиях и рН среды; 3) протекают в две фазы: а) взаимодействие антигена с антителом, или специфическая фаза; 6) образование видимого невооруженным глазом иммунного комплекса антитело-антиген, или неспецифическая фаза.
Для определения родовой, видовой и типовой принадлежности микробов иммунные диагностические сыворотки получают путем многократного введения животным в нарастающих дозах убитых или живых микроорганизмов, продуктов их распада, токсинов и анатоксинов Иногда для активации антителообразования применяют адъюванты 'как стимуляторы иммуногенеза.
После определенного цикла иммунизации животных проводят пробное кровопускание и определяют титр антител. Если в сыворотке содержится достаточное количество антител, делают массивное кровопускание или тотальное обескровливание животного. Кровь, собранную в стерильную посуду, сначала помещают в термостат при температуре 37° С на 4—6 для ускорения свертывания, затем —на сутки в ледник. Полученную прозрачную сыворотку отсасывают в стерильную посуду, добавляют консерванты (мертиолат, хинозол), проверяют на стерильность и разливают в ампулы.
К диагностическим сывороткам относятся: 1) агглютинирующие бактерии (корпускулы); 2) преципитирующие, предназначенные для выявления некорпускулярных антигенов; 3) гемолитическая, используемая в реакции связывания комплемента; 4) антитоксические и антивирусные, используемые для типирования токсинов и вирусов в реакции нейтрализации.
Выпускают также люминесцентные сыворотки, иммуноглобулины которых метятся флюорохромами. Применяются они для ускоренной диагностики инфекционных болезней.
В качестве антигенов в серологических реакциях используют взвеси живых и убитых бактерий, продукты их расщепления, токсины, экстракты тканей животных.
РЕАКЦИЯ АГГЛЮТИНАЦИИ
Агглютинацией называется склеивание бактерий при действии на нх специфических антител в присутствии электролита. Ее используют:
1) для определения вида и серовара выделенных бактерий (серотипаж);
2) для обнаружения антител в сыворотке крови больного (серодиагностика).
Для постановки реакции агглютинации (РА) необходимы три компонента: антиген (агглютиноген), антитело (агглютинин) и электролит (изотонический раствор натрия хлорида). В качестве антигена в РА применяют взвеси живых и убитых бактерий (диагностикумы).
Для получения агглютинирующих сывороток обычно иммунизируют кроликов. При этом им 5—7 раз подкожно, а затем внутривенно с интервалами 2—7 суток в возрастающих дозах вводят взвесь убитых, а в конце — 2-3 раза живых бактерий. Через неделю после иммунизации определяют титр сыворотки, или максимальное ее разведение, которое агглютинирует гомологичный микроорганизм. Если титр сыворотки недостаточен, иммунизацию продолжают. Полученные таким образом агглютинирующие сыворотки называются неадсорбированными, поскольку содержат групповые агглютинины и могут в небольших разведениях склеивать родственные в антигенном отношении бактерии. Поэтому для определения вида бактерий надо ставить развернутую реакцию с сывороткой, разведенной от 1: 100 до ее титра. Сыворотка соответствует микроорганизму в том случае, если как минимум агглютинирует его до половины титра.
Более достоверные результаты при определении вида или серовар бактерий дают адсорбированные (монорецепторные или типоспецифические) сыворотки, которые не имеют групповых агглютининов, вследствиечего нет необходимости разводить их. Реакцию агглютинации в нихставят на предметном стекле.
Ориентировочная, или пластинчатая реакция агглютинации. Ориентировочную РА выполняют перед постановкой развернутой реакции для того, чтобы отобрать на среде агглютинирующиеся в сыворотке колонии бактерий (культуры) и исключить из дальнейших исследований неагглютинирующиеся. Ставят ее при комнатной температуре на предметном стекле (рис. 5, а). Для этого на его поверхность пастеровской пипеткой раздельно наносят 2—3 капли различных сывороток в разведениях 1: 10—1: 20 и каплю 0, 5 % раствора хлорида натрия (контроль РА). В каждую каплю за исключением контрольной вносят подозрительные колонии (пе
Рис. 4. Классы иммуноглобулинов
Первые три класса иммуноглобулинов являются мономерами, т. е. бивалентными, содержащими два антигенсвязывающих центра: IgM — полимер, состоит из пяти мономерных молекул, связанных в области Fc-фрагментов особыми j -цепями. Валентность IgA различна. В сыворотке крови IgА, как и IgG, имеет мономерную структуру, а в секретах слизистых оболочек, межтканевой жидкости — в виде димеров (двух мономерных молeкул). Эти так называемые секреторные IgAS связаны особым полипептидом, который защищает димеры от воздействия протеолитических ферментов.
Физико-химические свойства Ig. По физико-химическим свойствам иммуноглобулины G, Е, D и А представляют собой белки с молекулярной массой 150000—350000, обозначаемые по константе седиментации как 7S (IgG, IgE, IgD, IgА), 7, 7-8, 0 S (IgА), 9-12 S (IgАS). Макроиммуноглобулины М имеют молекулярную массу 900000 и константу седиментации 19 S.
Биологические свойства Ig. Касаясь биологических свойств иммуно-глобулинов, нужно отметить, что содержание их в крови непостоянно и колеблется от 0, 3-0, 4 мг% (IgЕ) до 50-420 мг% (IgА и IgМ) и 800-1680 мг% (IgG).
На первичное введение в организм антигена вырабатываются IgM. Отличаются они выраженной авидностью (жадностью), т. е., обладая 10 антигенсвязывающими центрами, образуют прочные соединения с антигенами, несущими множественные эпитопы, вызывают агглютинацию и лизис клеток, обеспечивают устойчивость к бактериальным инфекциям.
Сохраняются IgМ, однако, недолго, и период их полувыведения не превышает 5 дней.
При повторном попадании антигена происходит бурная выработка IgG, обеспечивающих нейтрализацию бактериальных токсинов и вирусов. Связываясь с микроорганизмами, IgG активируют образование комплемента, вызывают хемотаксис нейтрофилов. Микрофаги быстро поглощают бактерии, обработанные IgG и комплементом, так как имеют рецептoры к Fс-фрагменту иммуноглобулина и С3-фракции комплемента. IgG легко проникает через барьеры, в частности сквозь плаценту, попадая в кровь новорожденных. В последующем титр их пополняется при кормлении грудью, что обеспечивает иммунитет младенца в первые недели жизни. Период полувыведения IgG равен 24 дням.
Иммуногло6улины А, АS, Е вырабатываются как на первичное, так на вторичное воздействие антигена. При этом сывороточные IgА накапливаются в крови. Секреторные IgАS продуцируются в слизистых оболочках кишечника, верхних дыхательных и мочевыводящих путей, содержатся в глазной жидкости, слюне, молоке и обеспечивают местный иммунитет тканей. Период полувыведения равен 6 дням.
IgE — цитофильный иммуноглобулин, в частности связывается с тучными клетками и базофилами крови. При реагировании с антигенами (микробами, веществами) в результате образования на их поверхности иммунных комплексов высвобождаются медиаторы воспалительной реакции.
Иммуноглобулин класса D находится на поверхности В-лимфоцитов вместе с мономерными IgМ составляет их рецепторы.
Взаимодействие иммуноглобулинов с антигенами. IgG, IgM, IgА реагируют с детерминантами антигенов всеми имеющимися в их молекуле антигенсвязывающими центрами. Вследствие этого в растворах о6разуются крупные конгломераты веществ. Антитела, вызывающие видимые реакции, называют полными. В противоположность этому некоторая часть IgE и IgG реагирует с антигеном лишь одним активным центром, видимых реакций не дает и поэтому называется неполными антителами. Если реакция
взаимодействия этих антител происходит в крови и не вызывает каких-либо нарушений в организме, их называют антителами-свидетелями. Последние блокируют антиген, а нередко одновременно связывают комплемент, вследствие чего называются блокирующими и комплементсвязывающими. Реагирование IgE с антигенами на поверхности клеток приводит к развитию аллергий. При незначительных, бесследно исчезающих проявлениях аллергии на кожных покровах антитела называют реагинами, а при ярко выраженных повреждениях клеток кожи — агрессинами или кожно-сенсибилизцрующими антителами.
ПРОЦЕСС АНТИТЕЛООБРАЗОВАНИЯ
Образование антител как иммунная реакция на антигены происходив в лимфоидной ткани периферических органов иммунитета, главным образом в лимфатических узлах и белой пульпе селезенки. Продуцентами антител являются плазмоциты.
Общая иммунная реакция на антиген. Начинается синтез антител с захвата антигенов макрофагами и появления в корковой зоне лимфатических узлов центров размножения (вторичных фолликулов) с большим количеством митотически делящихся лимфоцитов и плазматических клеток. В первые сутки после введения антигена резко снижается выход лимфоцитов из лимфатических узлов, а в последующие 3—4 дня, наоборот, значительно возрастает и ведет к интенсивной миграции (расселению) стимулированных лимфоцитов через кровь во все лимфоидные ткани и органы.
Фазы антителообразоваиия. В динамике образования антител различают две фазы — индуктивную (латентную) и продуктивную, или репродуктивную.
Индуктивной фазой называют отрезок времени между введение антигена и появлением следов антител или первых плазмоцитов. В этой фазе происходит распознавание антигена. Он фагоцитируется (пиноцтируется) макрофагами или же связывается гастиоцитами. Если вслед за этим антиген полностью разрушается, то антитела не вырабатываются. Антителогенез происходит лишь при частичной деградации антигена. В таком случае в лимфоидной ткани, где происходит связывание антиген отмечаются массовая гибель и параллельно пролиферация клеток, появляется большое количество фагоцитов, увеличивается содержание в ней гистамина, гепарина, серотонина и других веществ, усиливающих воспаление. На фоне воспаления в конце индуктивной фазы начинается кооперация (взаимодействие) между макрофагами, на мембране которых находится измененный антиген, Т- и В-лимфоцитами, в результате чего молодые В-лимфоциты получают сигнал к пролиферации и дифференцируются в плазмоциты.
Индуктивная фаза длится примерно 20 ч. Она очень лабильна. Начавшийся процесс антителообразования в этой фазе можно приостановить воздействием неблагоприятных для организма факторов. Наиболее легко это удается с помощью радиации, вследствие чего индуктивную фазу антителогенеза называют радиочувствительной.
В продуктивной фазе происходит интенсивный синтез антител. остановить его нельзя даже облучением и поэтому продуктивную фазу можно назвать радиорезистентной. В этой фазе иммунного ответа кооперация иммунокомпетентных клеток, темп деления В-лимфоцитов резко усиливаются. В частности, на смену молодым клеткам типа плазмобластов (иммунобластов) в лимфоидной ткани появляются вначале юные, а затем зрелые плазматические клетки. При первичном иммунном ответе максимальное количество плазмоцитов в селезенке и лимфатических узлах появляется на седьмые сутки. Это совпадает с самым высоким титром антител в крови. Повторное введение чужеродного антигена сопровождается необычно интенсивным процессом антителообразования. При этом плазмоциты появляются через 48 ч, а максимальный титр антител — на 3-4-есутки. Это связано с наличием у иммунизированных индивидуумов специальных клеток иммунологической памяти, которые являются, по сути, юными плазмоцитами с незаконченным циклом трансформации. Естественно, что при повторном воздействии антигена они, проделав несколько делений, в считанные часы превращаются в зрелые плазмоциты.
Продуктивная фаза антителообразования сравнительно непродолжительна. Применительно к одному клону она длится около 10 суток, но по отношению ко многим из них может увеличиться до нескольких недель, однако через 2—3 месяца титр антител в крови переболевших инфекционными заболеваниями резко снижается.
Функциональные особенности плазмоцитов. Касаясь функциональных особенностей плазмоцитов, следует подчеркнуть, что они могут рассматриваться как своеобразные одноклеточные 6елковые железы. Как правило, плазмоциты образуют антитела одной иммунологической специфичности, например Н- или О-антитела к соответствующим жгутиковым и соматическим антигенам бактерий, Более того, при наличии в молекуле антигена двух разных детерминант плазмоцит вырабатывает антитела против одной из них. Только 0, 01 % плазмоцитов продуцирует оба антитела. Первичный иммунологический ответ о6ычно начинается с синтеза IgМ. При вторичном ответе на антиген образуются микроглобулины IgG. Развитие клона плазмоцитов, начиная от плазмобласта до зрелой формы, занимает 5—6 суток. Жизненный цикл плазмоцитов, продуцирующих тот или иной вид антител, не превышает 48 ч. При этом вырабатывающиеся клоном плазмоцитов антитела представляют собой широкий спектр иммуноглобулинов, отличающихся по специфичности к различным детерминантам антигена.
АЛЛЕРГИЯ (ГИПЕРЧУВСТВИТЕЛЬНОСТЬ)
Под аллергией понимают неадекватный по силе иммунный ответ организма на определенное вещество-агент (аллерген), связанный с повышенной к нему чувствительностью (гиперчувствительностью). Аллергия специфична и возникает при повторном контакте с аллергеном, вызвавшим изменение иммунореактивности организма. Аллергия свойственна теплокровным животным и особенно человеку. Ее формирование в большей мере обусловлено способностью млекопитающих вырабатывать аллергические (анафилактические) IgЕ.
Природа и классификация аллергенов. Аллергию вызывают многочисленные факторы окружающей среды, но чаще всего химические вещества, обладающие свойствами иммуногенов и гаптенов. По резервуару их образования все аллергены делят на экзоаллергены, попадающи извне, и эндоаллергены, образующиеся в самом организме. Экзоаллергены, с которыми контактирует человек, в свою очередь подразделяют на аллергены неинфекционного и инфекционного происхождения. Среди неинфекционных аллергенов различают бытовые, эпидермальные (перхоть, шерсть, волосы), лекарственные (пенициллин, сульфаниламиды и др.), промышленные (формалин, бензол), пищевые. Отдельно выделяют поллинозы, вызываемые цветочной пыльцой растений (лат: ро11еп -пыльца). Наиболее сильными сенсибилизирующими свойствами среди аллергенов инфекционного происхождения обладают аллергены патогенных грибков, бактерий и вирусов.
Типы аллергических реакций. Аллергии — это иммунные гуморально-клеточные реакции сенсибилизированного организма на повторное воздействиё аллергенов. В настоящее время различают реакции гиперчувствительности немедленного типа (ГНТ) и реакции гиперчувствительности замедленного типа (ГЗТ). К ГНТ относят анафилактический шок, сывороточную болезнь, бронхиальную астму, сенную лихорадку, крапивницу, непереносимость к пищевым и лекарственным веществам. Столь же многочисленна группа реакций ГЗТ. К этой категории гиперчувствительности, в частности, относят инфекционную аллергию на бактерии, вирусы и грибы; аллергию на антибиотики и химические вещества; воспалительные реакции при отторжении трансплантата.
Механизм и общая характеристика реакций ГНТ. В основе возникновения реакций ГНТ лежит процесс взаимодействия между IgE и аллергеном. При этом нужно иметь в виду, что молекулы IgЕ фиксированы на тучных и других клетках тканей, базофилах крови, а у сенсибилизированных лиц (особей) они в большом количестве обнаруживаются в крови.
В развитии ГНТ различают три фазы: иммунологическую, патохимическую и патофизиологическую.
В иммунологической фазе аллерген реагирует с цитофильными и свободноплавающими в крови и межтканевой жидкости антителами.
В патохим.ической. фазе, наступающей вслед за образованием иммунных комплексов на внешних мембранах туч»ых клеток и базофилов, высвобождаются биологически активные вещества, которые повышают проницаемость капилляров и слизистых оболочек, способствуют всасыванию аллергенов и развитию 6ыстрой воспалительной реакции. Реагирование аллергенов со свободноплавающими IgЕ (по старой терминологии - с анафилаксинами) сопровождается 6ыстрsм связыванием комплемента, изменением коллоидного состава и свертываемости крови.
В патофизиологической фазе при различных реакциях ГНТ отмечаются отек слизистых оболочек, покраснение и зуд кожных покровов (крапивница, сенная лихорадка), удушье в результате спазма гладкой мускулатуры бронхов (астма), припухлость и болезненность суставов (сывороточная болезнь), другие местные воспалительные реакции, а при резких нарушениях деятельности сердечно-сосудистой системы —внезапно возникающий анафилактичесуий шок.
Реакции ГНТ проявляются в ближайшие 15 —20 мин после воздействия специфического аллергена; вызываются аллергенами антигенной и неантигенной природы; являются следствием взаимодействия аллергенов с аллергическими антителами. Реакции передаются пассивным путем, посредством введения сывороток сенсибилизированных животных. В 6ольшинстве случаев состояние гиперчувствительности к аллергену можно легко снять путем десенси6илизации.
Механизм и общая характеристика реакций ГЗТ. Реакции ГЗТ обусловлены взаимодействием Т-лимфоцитов с соответствующим аллергеном. В развитии ГЗТ выделяют те же три фазы реакции. В иммунологической фазе аллерген реагирует с неиммунными лимфоцитами, которые в результате бласттрансформации превращаются в зрелые эффекторные тимоциты, способные узнавать «свой» аллерген. В патохимической фазе сенсибилизированные лимфоциты выделяют лимфотоксины, факторы, которые обусловливают хемотаксис и усиливают фагоцитоз, защищают фагоциты от повреждения и ингибируют миграцию макрофагов и др.
Патофизиологическая фаза проявляется выраженной реакцией воспаления в разных тканях и органах.
Реакции ГЗТ развиваются в течение многих часов или нескольких суток после контакта с аллергеном; вызываются после длительного воздействия инфекционных аллергенов и химических веществ; протекают в самых разнообразных тканях с явлением, альтерации (повреждения) клеток сенсибилизированными лимфоцитами; пассивная передача сыворотками сенсибилизированных животных невозможна и достигается введением взвеси Т-лимфоцитов; десенсибилизировать ГЗТ, как правило, не удается.
В заключение следует подчеркнуть, что провести резкую грань между реакциями ГНТ и ГЗТ невозможно. Вначале, по-видимому, формируется ГЗТ как Т-клеточная реакция организма на аллерген, а после выработки иммуноглобулинов проявляется в виде ГНТ. Возможно, обе реакции развиваются параллельно и независимо одна от другой. В ответ на повторное воздействие аллергена у разных животных возникает то ГНТ, то ГЗТ либо обе реакции гиперчувствительности одновременно.
ПАТОГЕНЕЗ И ХАРАКТЕР ПРОЯВЛЕНИЯ
АНАФИЛАКСИИ И ИНФЕКЦИОННОЙ АЛЛЕРГИИ
В возникновении различных типов аллергий ведущее значение принадлежит индивидуальной иммунной реактивности организма человека Однако есть аллергии, доминирующую роль в развитии которых играет характер аллергена. К ним относят анафилактический шок и инфекционную аллергию.
Анафилаксия. Анафилаксия (греч. aha — обратное и jilakziz —действие или беззащитность) представляет собой реакцию гиперчувствительности немедленного типа, которая чаще всего возникает при повторном парентеральном введении чужеродной сыворотки или пенициллина.
Виды анафилаксии. По признаку генерализации различают общую и местную анафилаксии, а по способу приобретения — активную и пассивную. Общая анафилаксия проявляется как системная реакция, нарушающая жизнедеятельность всего организма, а местная — как локальная, ограниченная определенным участком кожи, ткани, органа. Активная анафилаксия является следствием выработки антител под влиянием аллергена, а пассивная — результатом пассивной передачи иммунных сывороток (иммуноглобулинов) от сенсибилизированных до норов.
Характеристика и проявление анафилактического шока. Самой тяжелой формой о6щей анафилаксии является анафилактический шок. Легче всего его вызвать у морских свинок, сенсибилизируя их лошадиной сывороткой. Вводят ее подкожно, внутрибрюшинно, внутривенно. Отмечено, что сенсибилизация животных происходит тем быстрее, чем меньше доза антигена. Эффективным является даже 0, 000001 мл сыворотки. Готовность животных отвечать анафилактическим шоком возникает спустя 9—12 дней инкубации и совпадает с моментом появления антител в крови. Реализуется шок при соблюдении двух условий: 1) повторная или разрешающая доза сыворотки должна превышать сенсибилизирующую в 10—100 раз и быть не меньше 0, 1 мл; 2) для развития шока разрешающую дозу антигена необходимо вводить в кровоток (внутривенно или внутрисердечно).
У морской свинки при возникновении анафилактического шока вначале появляются возбуждение, одышка, затрудненное дыхание, далее, после конвульсивных прыжков, животное падает и погибает, выделяя кал и мочу. При вскрытии павших животных отмечаются резкая эмфизема легких вследствие спазма гладкой мускулатуры бронхов, кровоизлияния в слизистые и серозные оболочки. У человека при возникновении анафилактического шока учащается пульс, повышается температура, возникает одышка, появляются судороги, отеки, боли в суставах, высыпания, резко нарушается деятельность сердечно-сосудистой системы. Смерть анафилаксии наступает редко.
В патогенезе анафилактического шока различают обычные для аллергической реакции ГНТ три стадии.
Местная анафилаксия возникает в коже, подкожной клетчатке и в органах при многократных инъекциях чужеродной сыворотки. При этом развивается гиперергическое воспаление с резко выраженным отеком и квоизлиянием в ткани, заканчивающееся их некрозом. Впервые активный тип гиперергической реакции с образованием глу6оких незаживающих язв в коже и подкожной клетчатке описал Н. Артюс у кроликов, которым 5—7 раз через 5 — 6 дней подкожно вводили лошадиную сыворотку. Феномен Артюса сравнительно легко передается пассивно путем парентерального введения сыворотки сенсибилизированного донора с последующей подкожной инъекцией реципиенту разрешающей дозы сыворотки. В основе развития местной анафилаксии лежит альтерация клеток иммунными преципитатами, связывающими комплемент.
Пассивная анафилаксия — это передача интактному животному состояния анафилаксии посредством введения сыворотки сенсибилизированного донора. Сенсибилизированный реципиент через несколько часов после фиксации в его тканях антител приобретает способность реагировать на введение соответствующего аллергена анафилактический шоком или местной анафилаксией. Пассивно переданная гиперчувствительность к аллергену сохраняется в организме морской свинки от 3—4 недель до 2 месяцев и полностью исчезает после разрушения введенных антител.
Инфекционная аллергия. Развитие инфекционной аллергии и природу ее иммунологической сущности описал Р. Кох. Повторно заражая морскую свинку микобактериями туберкулеза, он обнаружил необычно бурную на них реакцию больного животного. На месте подкожного введения суперинфицирующей дозы в считанные дни возникала язва и вместе с некротической тканью удалялись бактерии туберкулеза, что предупреждало их, распространение в регионарные лимфатические узлы и через кровь — во внутренние органы свинки.
Подобное состояние гиперчувствительности характерно для многих инфекционных заболеваний, но интенсивность проявления этой аллергической реакции не имеет столь яркого характера, как при туберкулезе. Этот тип ГЗТ выявляют с помощью диагностических проб, в которых используются аллергены. Готовятся они из фильтратов бульонных культур, взвесей убитых микроорганизмов или их экстрактов. Вводят аллергены в организм человека накожно или внутрикожно. Накожныё пробы проводят с помощью скарификатора, которым через каплю аллергена, нанесенную в нижней трети предплечья, делают две параллельные поверхностные насечки кожи длиной 5 мм, избегая повреждения сосудов и появления крови. Внутрикожно аллерген вводится туберкулиновым шприцем в количестве 0, 05—0, 1 мл.
Следует подчеркнуть, что скарификационные пробы более специфичны, чем внутрикожные, но последние во стократ чувствительнее первых. При положительных реакциях на месте введения аллергена спустя 24 - 48 ч возникает инфильтрат, состоящий преимущественно из лимфоцитов моноцитов и макрофагов, что визуально проявляется покраснением и припухлостью диаметром более 10 мм.
Оценивая аллергические пробы, нео6ходимо учитывать возможность получения ложноположительных реакций у людей с повышенной чувствительностью кожи или же из-за из6ыточного введения аллергена и нарушения техники их производства. Положительные, но не диагностические аллергические пробы могут регистрироваться у привитых лиц (поствакцинальные), переболевших (анамнестические) или же у больных другим инфекционным заболеванием, возбудитель которого имеет сходные групповые аллергены. В о6щем говоря, положительные аллергические пробы свидетельствуют об инфицированности людей. С учетом этих оговорок они нашли широкое применение в экспресс-диагностике туберкулеза и микобактериозов, лепры, бруцеллеза, туляремии, сапа, актиномикоза, токсоплазмоза, дерматомикозов и др.
ИММУНОПРОФИЛАКТИКА И ИММУНОТЕРАПИЯ
ВАКЦИНЫ
Вакцины — это биологические препараты, предназначенные для создания у людей, животных и птиц иммунитета к инфекционным заболеваниям или реже — к ядам. Имеются корпускулярные и некорпускулярные вакцины. Корпускулярные вакцины содержат аттенуированные (осла6ленные) или убитые микро6ы, некорпускулярные — продукты их химического расщепления (химические вакцины), о6езврежениые экзотоксины бактерий или яды животного и растительного происхождения (анатоксины). По числу антигенов, входящих в вакцину, различают моно- и поливакцины (ассоциированные), по видовому составу – бактериальные, риккетсиозные, вирусные.
Живые вакцины - это, как правило, моновакцины. Одни из них содержат ослабленные бактерии (бруцеллезная, туляремийная, чумная, сибироязвенная, туберкулезная вакцины), другие — вирусы (против натуральной оспы, желтой лихорадки, 6ешенства, полиомиелита, кори, эпидемического паротита). Живые вакцины наиболее иммуногенны и обычно создают напряженный и длительный иммунитет, вследствие того, что измененные штаммы (мутанты) сохраняют свойство размножаться (репродуцироваться) в привитом организме, вызывая миниатюрную вакцинную инфекцию, сжатую в сроках течения и сглаженную по тяжести проявления. Например, противооспенная и туляремийная вакцины обеспечивают устойчивость на протяжении 5—7 лет. Исключение составляет, пожалуй, только антигриппозная вакцина, создающая выраженный иммунитет на 6-8месяцев. К недостаткам живых вакцин относится то, что они очень, реактогенны (энцефалитогенны), обладают аллерргическими свойствами, за счет остаточной вирулентности могут вызывать серьезные осложнения, вплоть до генерализации вакцинного процесса и развития менингоэнцефалита.
Убитые вакцины (брюшнотифозная, паратифозная А и В, дизентерийная, холерная, коклюшная, лептоспирозная, сыпнотифозная, против гриппа, полиомиелита, клещевого энцефалита) используются в виде моно- и поливакцин. Некоторые из них (лептоспирозная, антигриппозная), лючающие несколько разновидностей (сероваров) возбудителя, называются поливалентными. Убитые вакцины слабоиммуногенны и создают непродолжительнЬш иммунитет сроком до года, по-видимому, потому, что в процессе их изготовления происходит денатурация антигенов.
Химцческие вакцины — это препараты, состоящие из полных антигенов микробных культур и очищенные от балластных веществ. Применяются для профилактики брюшного тифа, паратифов А и В (вакцина TABte со столбнячным анатоксином), коклюша, туберкулеза. Разрабатывается метод получения вакцин из протективных антигенов и рибосом. Реактогенность хорошо очищенных вакцин незначительна. По профилактической эффективности химические вакцины превосходят убитые корпускулярные.
Анатоксины (столбнячный, дифтерийный, гангренозные, ботулинический, стафилококковый) относительно мало реактогенны, создают напряженный и длительный иммунитет до 4-5 лет и более.
В настоящее время в арсенале средств борьбы с инфекционными (заболеваниями насчитывается около 30 вакцинальных препаратов против бактериальных, вирусных, риккетсиозных инфекций.
Общая характеристика вакцин будущего. Синтетические вакцины — безбалластные вакцины, содержащие естественные или искусственно синтезированные микробные (вирусные) протективные антигены, не обладающие побочным токсическим действием. Для усиления иммунного ответа они конъюгируются со специально подобранными Т-зависимыми носителями и введены в адъюванты (иммуномодуляторы), которые стимулируют образование высоких титров антител.
Рекомбинантные вакцины — искусственно созданные вакцины, содержащие рекомбинантные вирусы или микробы-химеры, в геномы которых введены гены других микробных видов, кодирующие один или несколько специфических антигенов. Таким путем, в частности, уже создан, рекомбинантный вирус оспенной вакцины, синтезирующий поверхностный HBs-антиген вируса гепатита В; кодирующий гемагглютинин вирус гриппа А; гликопротеины вирусов простого герпеса и везикулярного стоматита. Экспрессия HBs-антигена осуществлена также в дрожжевых клетках, отличающихся необычайно высокой иммуногенностью и полной безвредностью.
Цели применения. Вакцины предназначаются для создания активного индивидуального и коллективного иммунитета. Чаще всего они используются для профилактики инфекционных заболеваний, реже для лечения (гонококковая, стафилококковая, спиртовая дизентерийная вакцины, Vi - антиген брюшнотифозной палочки, бруцеллезная вакцина).
Способы изготовления. Для получения вакцин применяют физические, химические, биологические факторы. Живые вакцины обычно получают, пассируя патогенные микробы через организм невосприимчивых животных, куриный эмбрион, культуры клеток, добиваясь резкого снижения вирулентности. Убитые бактериальные вакцины гртовят по методу Колле, для чего микробы выращивают на плотных средах, смывают, стандартизируют, обезвреживают нагреванием (гретые вакцины) или воздействием химических соединений (формолвакцины, фенолвакцины, ацетоновые и т. п.). Анатоксины получают по методу Рамона, который для детоксикации бактериальных экзотоксинов предложил прибавлять к ним 0, 3—0, 8 % формалина с последующим выдерживанием на протяжении 3—4 недель при температуре 37—42 " С.
Пути введения вакцин. Вакцины вводят в организм накожно, внутрикожно, подкожно, через рот и нос. В последние годы широкое распространение получил метод массовой вакцинации с помощью безыгольных, инъекторов. С той же целью разрабатывается аэрогенный способ одновременной аппликации вакцины на слизистые оболочки верхних дыхательных путей, глаз и носоглотки.
Схема вакцинации. Живые вакцины, кроме полиомиелитной, применяются однократно, убитые корпускулярные, химические вакцины и анатоксиньг вводятся два-три раза с интервалами от 7—10 до 25-40 дней. Ввиду того что многократная вакцинация не обеспечивает высокого охвата населения прививками, применяются депо-вакцины. В качестве депонирующих веществ используют минеральные коллоиды, чаще всего гели гидроксида или фосфата алюминия, масла, которые как адсорбенты обеспечивают постепенное длительное воздействие антигенов на организм, а некоторые на них, например сложные адъюванты типа Фрейнда, неспецифически стимулируют антителогенез.
Плановые прививки. Вакцинацию проводят в плановом порядке и по эпидемическим показаниям (при возникновении заболеваний). Проведение прививок регулируется государственными законами и является общественной мерой борьбы с инфекциями. В настоящее время принят четкая программа иммунизации детей. На первом году жизни ребенка прививают против туберкулеза (в роддоме на 5-7-й день), полиомиелита (в 3 мес.), коклюша, дифтерии и столбняка (в 4 — 5 мес.), а по достиженм года иммунизируют антикоревой вакциной.
ИММУННЫЕ СЫВОРОТКИ (ГАММА-ГЛОБУЛИНЫ)
Сывотортка – жидкая часть крови, лишенная фибриогена. Она образуется при свертывании крови и отделении плазмы от сгустка и форменных элементов.
Классификация. Сыворотки бывают нормальные и иммунные с повышенным титром иммуноглобулинов; гомологичные, полученные от человека, и гетерологичные, или чужеродные, полученные от специально иммунизированныx животных. Иммунные сыворотки по целевому назначению подразделяют на лечебно-профилактические и диагностические, а по характеру содержащихся в них антител — на антитоксические и антимикробные.
Диагностические сыворотки, как уже было сказано, используются для идентификации патогенных микробов. С помощью лечебно-профилактических сывороток создается пассивный иммунитет. Надобность в нем возникает при инфицировании (серопрофилактика) или заболевании (серотерапия).
Антитоксические сыворотки нейтрализуют бактериальные экзотоксины и применяются для лечения и профилактики токсинемических инфекций. К ним относятся противодифтерийная, противостолбнячная, антистафилококковая, против анаэробной инфекции, противоботулиническая сыворотки.
Антимикробные сыворотки обезвреживают бактерии и вирусы. Лучшими из них являются вируснейтрализующие сыворотки, в частности антикоревая, противооспенная, антирабическая, противоэнцефалитная, противополиомиелитная и противогриппозная. Лечебно-профилактическая эффективность антибактериальных сывороток низка, они используются главным образом для профилактикй коклюша и лечения чумы, сибирской язвы, лептоспироза.
Титрование антитоксических лечебных сывороток. Антитоксические сыворотки титруются в антитоксических или международных единицах (AЕ или МЕ). За 1 АЕ принимают минимальное количество сыворотки, предохраняющее определенный вид животных от гибели при заражений специально подобранной дозой токсина. Так, 1 АЕ антидифтерийной сыворотки — это наименьшее количество сыворотки, которое на протяжении 4 суток предохраняет от смерти морскую свинку массой 250 г, инфицированную 100 ДLМ дифтерийного токсина.
Антибактериальные и антивирусные сыворотки не титруются и вводятся по клиническим показаниям в миллилитрах. При определении их лечебной дозы учитываются тяжесть, день заболевания и возраст больного.
Методы получения сыворотки. Лечебные и профилактические гетерологичные сыворотки получают путем иммунизации лошадей, поскольку эти животные более реактогенны, чем другие, и дают большой выход антител. Кроме того, лошадиный белок наименее анафилактогенен. Для получения антитоксических сывороток лошадей вначале иммунизируют анатоксином, а после создания базисного иммунитета — возрастающим дозами токсина. Антибактериальные сыворотки получают путем введения животным убитых или живых микробов.
Нередко для лечения и профилактики инфекционных болезней используются гомологичные сыворотки здоровых доноров, пере6олевших людей или препараты плацентарной крови.
Гамма-глобулины. В целях концентрации иммуногло6улинов, снижения токсичности и уменьшения аллергического действия сыворотки освобождают от балластных белков. При этом используют методы фракционирования сывороток с помощью спирто-водных смесей при температуре 0 " С, ультрацентрифугирования, электрофореза, ферментативного гидролиза (метод диаферм). Очищенные и концентрированные препараты гамма-глобулиновой фракции сывороточных 6елков, содержащие высокие титры антител, называют иммуноглобулинами, а в практике - гамма-глобулинами. В сравнении с нативной сывороткой они более авидны, быстрее реагируют и прочно связываются с антигеном. Применение гамма-гло6улинов снизило количество и тяжесть осложнений, возникающих при введении гетерологичных сывороток. Важно и то, что современная технология изготовления человеческого гамма-глобулина гарантирует полную ги6ель вирусов гепатита.
Способы введения. Сыворотки и гамма-гло6улины вводят в организм различными путями: подкожно, внутримышечно, внутривенно или в спинномозговой канал. После введения иммунной сыворотки пассивный иммунитет возникает спустя несколько часов и продолжается 8—15 дней..
Специфическая десенсибилизация (гипосенсибилизация) анафилаксий. У сенсибилизированных чужеродной сывороткой животных анафилактическое состояние сохраняется в течение многих месяцев, а у человека — практически всю жизнь. В целях предупреждения анафилаксий у человека А. М. Безредка предложил вводить сыворотку небольшими дозами многократно, постепенно связывая анафилактические антитела Этот способ профилактики анафилактического шока называют специфической десенсибилизацией. Проводя ее, предварительно определяют чувствительность организма к белку. С этой целью в сгибательную поверхность предплечья внутрикожно вводят 0, 1 мл чужеродной сыворотки разведенной 1: 100. При отрицательной реакции, проявляющейся с образованием папулы диаметром 9 мм с небольшим ободком покраснения, через 20—30 мин поочередно вводят 0, 1 мл и 0, 2 мл цельной сыворотки, а спустя 1 —1, 5 ч всю остальную дозу. При положительной внутрикожной пробе с инфильтратом более 10 мм десенсибилизация вначале проводится разведенной 1: 100 сывороткой в дозах 0, 5, 1, 0, 2, 0, 5 мл с интервалами в 20 мин, а затем с теми же промежутками 3 раза цельной — 0, 1, 0, 2, оставшийся объем. Состояние десенсибилизации непродолжитёльно и через 5—14 дней вновь появляется исходная гиперчувствительность.
Гомологичные сыворотки (сыворотки человека) анафилактических реакций не вызывают. При нео6ходимости лечебную дозу этих сывороток вводят одновременно. Так, гамма-глобулин из сыворотки человек для профилактики кори вводят внутримышечно в количествё 1, 5—З мл., Для лечения и профилактики инфекционных заболеваний сыворотки и гамма-глобулины должны вводиться как можно раньше после заражения или заболевания. Например, противостолбнячную сыворотку следует использовать в первые 12 ч от момента ранения, а противодифтерийную — не позднее 2-4 ч после постановки диагноза.
СЕРОЛОГОЧЕСКИЕ РЕАКЦИИ ИММУНИТЕТА
Серологическими называют такие реакции, для постановки которых используют сыворотку (serum), содержащую антитела.
Серологические реакции применяют: а) для идентификации микроорганизмов, токсинов, любого другого антигена с помощью известного антитела (иммунная диагностическая сыворотка); б) для определения природы антитела в сыворотке крови с помощью известного антигена (диагностикум).
Основными серологическими реакциями являются реакции агглютинации, преципитации, связывания комплемента, иммунофлюоресценции, нейтрализации вирусов на культурах клеток, куриных эмбрионов и животных, реакция торможения гемагглютинации.
Общие закономерности серологических реакций: 1) реакции ставятся in vitro; 2) проявляются при иммунологическом соответствии (гомологичности) антигена и антитела, в оптимальных температурных условиях и рН среды; 3) протекают в две фазы: а) взаимодействие антигена с антителом, или специфическая фаза; 6) образование видимого невооруженным глазом иммунного комплекса антитело-антиген, или неспецифическая фаза.
Для определения родовой, видовой и типовой принадлежности микробов иммунные диагностические сыворотки получают путем многократного введения животным в нарастающих дозах убитых или живых микроорганизмов, продуктов их распада, токсинов и анатоксинов Иногда для активации антителообразования применяют адъюванты 'как стимуляторы иммуногенеза.
После определенного цикла иммунизации животных проводят пробное кровопускание и определяют титр антител. Если в сыворотке содержится достаточное количество антител, делают массивное кровопускание или тотальное обескровливание животного. Кровь, собранную в стерильную посуду, сначала помещают в термостат при температуре 37° С на 4—6 для ускорения свертывания, затем —на сутки в ледник. Полученную прозрачную сыворотку отсасывают в стерильную посуду, добавляют консерванты (мертиолат, хинозол), проверяют на стерильность и разливают в ампулы.
К диагностическим сывороткам относятся: 1) агглютинирующие бактерии (корпускулы); 2) преципитирующие, предназначенные для выявления некорпускулярных антигенов; 3) гемолитическая, используемая в реакции связывания комплемента; 4) антитоксические и антивирусные, используемые для типирования токсинов и вирусов в реакции нейтрализации.
Выпускают также люминесцентные сыворотки, иммуноглобулины которых метятся флюорохромами. Применяются они для ускоренной диагностики инфекционных болезней.
В качестве антигенов в серологических реакциях используют взвеси живых и убитых бактерий, продукты их расщепления, токсины, экстракты тканей животных.
РЕАКЦИЯ АГГЛЮТИНАЦИИ
Агглютинацией называется склеивание бактерий при действии на нх специфических антител в присутствии электролита. Ее используют:
1) для определения вида и серовара выделенных бактерий (серотипаж);
2) для обнаружения антител в сыворотке крови больного (серодиагностика).
Для постановки реакции агглютинации (РА) необходимы три компонента: антиген (агглютиноген), антитело (агглютинин) и электролит (изотонический раствор натрия хлорида). В качестве антигена в РА применяют взвеси живых и убитых бактерий (диагностикумы).
Для получения агглютинирующих сывороток обычно иммунизируют кроликов. При этом им 5—7 раз подкожно, а затем внутривенно с интервалами 2—7 суток в возрастающих дозах вводят взвесь убитых, а в конце — 2-3 раза живых бактерий. Через неделю после иммунизации определяют титр сыворотки, или максимальное ее разведение, которое агглютинирует гомологичный микроорганизм. Если титр сыворотки недостаточен, иммунизацию продолжают. Полученные таким образом агглютинирующие сыворотки называются неадсорбированными, поскольку содержат групповые агглютинины и могут в небольших разведениях склеивать родственные в антигенном отношении бактерии. Поэтому для определения вида бактерий надо ставить развернутую реакцию с сывороткой, разведенной от 1: 100 до ее титра. Сыворотка соответствует микроорганизму в том случае, если как минимум агглютинирует его до половины титра.
Более достоверные результаты при определении вида или серовар бактерий дают адсорбированные (монорецепторные или типоспецифические) сыворотки, которые не имеют групповых агглютининов, вследствиечего нет необходимости разводить их. Реакцию агглютинации в нихставят на предметном стекле.
Ориентировочная, или пластинчатая реакция агглютинации. Ориентировочную РА выполняют перед постановкой развернутой реакции для того, чтобы отобрать на среде агглютинирующиеся в сыворотке колонии бактерий (культуры) и исключить из дальнейших исследований неагглютинирующиеся. Ставят ее при комнатной температуре на предметном стекле (рис. 5, а). Для этого на его поверхность пастеровской пипеткой раздельно наносят 2—3 капли различных сывороток в разведениях 1: 10—1: 20 и каплю 0, 5 % раствора хлорида натрия (контроль РА). В каждую каплю за исключением контрольной вносят подозрительные колонии (пе
|
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав.
Копирование текстов разрешено только с указанием индексируемой ссылки на источник.