
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дата: 17.04.13
|
|
Пропись № 1 Rp: Sol. Ac. borici 2% – 70 ml
Раствор кислоты борной 2%-70 мл
Описание: Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 70 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Кислота борная. Выпаривают 5 капель раствора на водяной бане. К сухому остатку прибавляют 2 мл 96% этанола и поджигают. Наблюдают пламя с зеленой каймой.
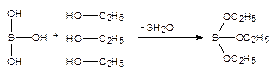
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота борная (методом нейтрализации в присутствии глицерина). Метод основан на реакции нейтрализации борной кислоты раствором натрия гидроксида.
К 0, 5 мл раствора прибавляют 1 каплю фенолфталеина, 1 мл глицерина, титруют 0, 1 моль/л раствором натрия гидроксида.
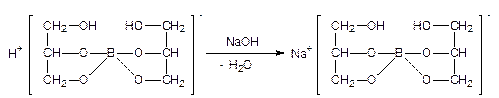
F=1
ТК.борной/NaOH=0, 1*61, 84/1000=0, 006184г/мл
Vтеор. = 0, 01/0, 006184 = 1, 62 мл
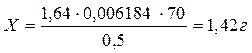
Абс.ошибка: 1, 42 – 1, 40= 0, 02;
Отн.ошибка: 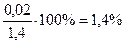 (по П №305 допустимо 5%).
(по П №305 допустимо 5%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Protargoli 2%-80ml
D.S. для инстилляций.
Раствор протаргола 2%-80 мл
Описание: Коричнево-желтый раствор, без запаха. В склянке из темного стекла. Общий объем – 80 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: Серебро в данном соединении находится в недиссоциированном состоянии. Сначала проводят минерализацию полным озолением. Полученный серовато-белый остаток обрабатывают азотной кислотой. Далее проводят реакции на ион серебра.
С хлорид ионом образует белый творожистый осадок серебра хлорида.
Ag++Cl- → AgCl↓
AgCl↓ +2NH3*H2O→ [Ag(NH3)2]Cl+2H2O
AgCl+(NH4)2CO3→ [Ag(NH3)2]Cl=CO2+H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: тиационатометрия.
1 мл исследуемого раствора титруют 0, 1 н раствором тиоцианата аммония.
Протаргол + HNO3→ AgNO3+CO2+H2O
AgNO3+NH4SCN→ AgSCN+NH4NO3
л.к. NH4SCN+FeNH4(SO4)2→ Fe(SCN)3+2(NH4)2SO4
Fэкв=1
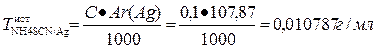
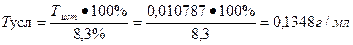
Расчет теоретического объема:
В 80 мл раствора - 1, 6 г кислоты хлороводородной
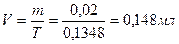 |
1 мл - 0, 02 г
На титрование ушел 0, 15 мл 0, 1 н раствором тиоцианата аммония, соответственно содержание исследуемого вещества в граммах равно:
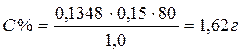
Абс.ошибка: 1, 62 – 1, 60= 0, 02;
Отн.ошибка: 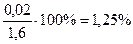 (по П №305 допустимо 5%).
(по П №305 допустимо 5%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
|
|