
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные термодинамические процессы
|
|
· Изохорный – при постоянном объеме;
· Изобарный – при постоянном давлении;
· Изотермический – при постоянной температуре;
· Адиабатный – при отсутствии теплообмена между рабочим телом и окружающей средой.
ИЗОХОРНЫЙ: V=const
· Все тепло, подводимое к системе идет на изменение внутренней энергии системы.
· Уравнение процесса: p1/T1=p2/T2
· Работа: Lv = 0
· Теплота: Qv = ∆ Uv =Mcv(T2 – T1)

ИЗОБАРНЫЙ ПРОЦЕСС p=const
n Теплота, сообщаемая системе, увеличивает её энтальпию.
n Уравнение процесса: v1/T1=v2/T2
n Работа: Lp = p(V2 – V1)
n Теплота: Qp =Mcp(T2 – T1)
n Изменение внутренней энергии: ∆ Up = Qp - Lp

ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Т=const:
n Теплота, сообщаемая системе, тратится на совершение внешней работы.
n Уравнение процесса: p1v1=p2v2
n Теплота: Qp = LT = RT ln(V2/V1)
n Изменение внутренней энергии: ∆ UT = 0
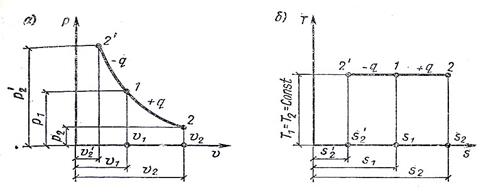
АДИАБАТНЫЙ ПРОЦЕСС Δ q=const:
n Внешняя работа совершается рабочим телом за счет изменения его внутренней энергии.
n Уравнение процесса: 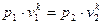
n Работа: LS = - ∆ US
n Теплота: QS = 0

ПОЛИТРОПНЫЙ ПРОЦЕСС
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости 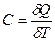 , предельными частными явлениями политропного процесса являются изотермический процесс (
, предельными частными явлениями политропного процесса являются изотермический процесс ( ) и адиабатный процесс (
) и адиабатный процесс (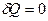 ).
).
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде: 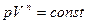
где р — давление, V — объем газа, n — «показатель политропы».
 . Здесь с — теплоёмкость газа в данном процессе, ср и cv — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
. Здесь с — теплоёмкость газа в данном процессе, ср и cv — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
- Изотермический процесс: n=1, так как T=const, значит, по закону Бойля — Мариотта
 , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
- Изобарный процесс: n=0, так как
 , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так: 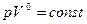 .
.
- Адиабатный процесс:
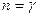 (здесь
(здесь 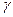 — показатель адиабаты), это следует из уравнения Пуассона (
— показатель адиабаты), это следует из уравнения Пуассона ( 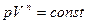 ).
).
- Изохорный процесс:
 , так как V=const, и в процессе
, так как V=const, и в процессе 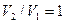 , а из уравнения политропы следует, что
, а из уравнения политропы следует, что  , то есть, что
, то есть, что 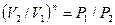 , то есть
, то есть 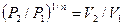 , а это возможно, только если n является бесконечным.
, а это возможно, только если n является бесконечным.
|
|