
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Строение циклоалканов
|
|
Циклоалканы представляют собой в определенной степени жесткие структуры.
Для циклоалканов характерны следующие виды напряжений:
1) торсионное (Питцеровское) напряжение – связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях;
2) напряжение Ван- дер- Ваальса – обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их ван-дер-ваальсовых радиусов;
3) угловое (Байеровское) напряжение – присуще отдельным циклоалканам и связано с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения.
Теория напряжения циклов была предложена немецким химиком-органиком А. Байером в 1885 г. Согласно этой теории циклоалканы представляют собой плоские многоугольники. Единственным фактором, определяющим прочность цикла, считалось наряжение, вызванное отклонением внутренних валентных углов цикла по сравнению с тетраэдрическим углом.
Если рассматривать форму циклоалканов в виде простых геомет-рических фигур, имеющих плоское строение, то можно отметить, что при переходе от одного цикла к другому происходит изменение валентного угла.
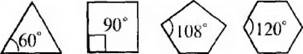
Чем значительнее отклонение, тем выше угловое напряжение и менее устойчивникл.
В соответствии с вышеприведенным, трехчленный цикл менее устойчив, чем четырехчленный, а последний – менее устойчив, чем пя~ тичленный. Эти представления подтверждались накопленным к тому времени экспериментальным материалом. Однако для шестичлеиного цикла экспериментальные данные вступали в противоречия с теорией. Шестичленные циклы (внутренний угол 120°), имеющие значительное отклонение валентных углов от тетраэдрического, оказались устойчивее пятичленных, в которых внутренние углы наиболее близки к тетраэдрическим.
Причиной несоответствия теории Байера с экспериментальным материалом явилось ошибочное представление о плоском строении циклов, В действительности же циклоалканы (исключая циклопропан) не имеют плоского строения.
Пространственное строение циклоалканов определяется разной конформационной подвижностью углеродных атомов, зависящей от числа звеньев в цикле, Молекула любого циклоалкана стремится принять в пространстве такую форму (конформацию), в которой сумма углового, торсионного и ван-дер-ваальсового напряжений была бы минимальной.
Наиболее жесткую структуру имеет циклопропан. В соответствии с правилами геометрии три точки всегда лежат в одной плоскости. Именно поэтому молекула циклопропана имеет плоское строение. Атомы водорода в данной молекуле находятся в заслоненной конформации, что и обуславливает сильное торсионное напряжение. Свободное вращение относительно углерод-углеродных связей невозможно. Внутренние валентные углы в молекуле циклопропана сильно отклонены от тетраэдрического значения, в результате чего и возникает большое угловое напряжение. Искажение валентных углов при 5/^-гибридизации орбиталей углеродных атомов должно составлять α = (109°28' - 60°): 2 = 24*44'.
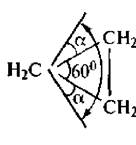
В действительности в молекуле циклопропана валентный угол равен 106°. Согласно квантовохимическнм представлениям изменение угла является результатом изменения гибридизации атомов углерода. Гибридизация орбиталей в молекуле циклопропана ближе к sp2 -гибридизации алкенов, чем к sp3 -гибридизации алканов (промежуточное положение).
Вследствие взаимного отталкивания электронных облаков углерод-углеродных связей максимальная электронная плотность перекрывающихся орбиталей атомов углерода в молекуле циклопропана расположена не по прямой, соединяющей центры связываемых атомов, а за пределами треугольника молекулы.
Образующиеся связи называют «банановыми» или τ -(греч. «тау») связями. Они занимают промежуточное положение между σ и π -связями. Образование τ -связей выгодно, так как валентные углы увеличиваются до 106° (вместо теоретически рассчитанных 60°) и снижается угловое напряжение молекулы.
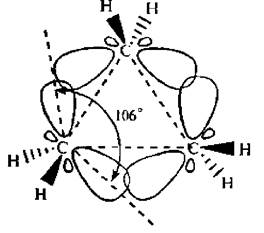
Рис. 7.1. Образование «банановых» связей в молекуле циклопропана
Четырехчленный цикл, в отличие от трехчленного, все же обладает незначительной гибкостью. Валентные углы искажены меньше, чем в трехчленном цикле, несколько ниже и угловое напряжение. Один из углерод ных атомов циклобутана выходит из плоскости трех атомов на угол 25–30% что приводит к уменьшению торсионного напряжения цикла.
В пятичленном цикле практически отсутствует угловое напряжение (отклонение внутренних валентных углов от тетраэдрического составляет менее 1°). Однако в плоском пятичленном цикле связи С–Н находятся в заслонен ной конформаций, что обуславливает значительное торсионное напряжение. Каждый из пяти углеродных атомов циклопента-на, стремясь уменьшить торсионное напряжение в цикле, поочередно выходит из плоскости, в которой расположены четыре оставшихся атома углерода. Кольцо находится в непрерывном волнообразном движении – псевдоврашении. Эта неплоская осциллирующая структура называется конформацией «конверта». В конформаций «конверта» угловое напряжение увеличивается, однако это в полной мере компенсируется снижением торсионного напряжения молекулы.
Если представить шестичленный цикл плоским, то его внутренние валентные углы должны быть равными 120°, Это обусловило бы значительное угловое напряжение. Следует отметить, что в плоской структуре появляются взаимодействия, связанные с заслонением С–Н-связей, то есть торсионное напряжение.
Однако же циклогексан не является плоской структурой и существует без углового напряжения, так как все валентные углы в нем тет-раэдрические (109*28').
До недавнего времени считали, что наиболее устойчивыми структурами циклогексана являются две изомерные конформации, взаимопревращающиеся друг в друга за счет поворота вокруг σ -связей без их разрыва: «кресла» С (от англ. chair– кресло) и «ванны» В (от англ. bоаt- лодка).

Более устойчивой является конформация «кресла», так как лишена торсионного напряжения (все атомы углерода и водорода находятся в заторможенной конформации). В конформации «ванны» происходит заслонение связей, расположенных вдоль двух параллельных боковых сторон молекулы, что обуславливает торсионное напряжение.
В настоящее время с помощью физико-химических методов исследования установлено, что циклогексан может существовать в различных конформациях: «кресло», твист-форма (искаженная ванна), «полукресло», «ванна». Второй по устойчивости является твист-форма.
Она образуется в результате «скручивания» конформации «ванны» в продольном направлении, что уменьшает напряжение в цикле,
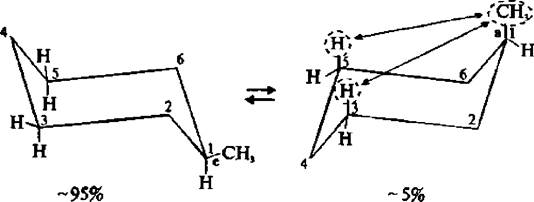
В обычных условиях преобладающая часть молекул циклогексана (99, 9 %) существует в конформации «кресла». В результате вращения вокруг углерод-углеродных связей одна конформация «кресла» переходит в другую, энергетически равноценную, форму кресла. Такой процесс называют инверсией цикла.

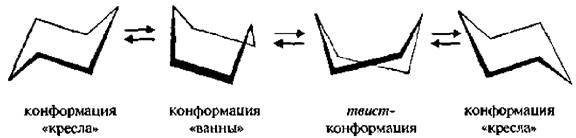
Две конформации «кресла» могут взаимно превращаться как с промежуточным образованием конформации «ванны», твист-конформации, так и без прохождения через конформацию «ванны».
Изучая пространственное строение циклогексана, было установлено, что шесть С–Н связей расположены впольоси симметрии молекулы, а другие шесть – под углом 109°28'. Связи, параллельные оси симметрии, называют аксиальными (обозначают символом «а»), а расположенные радиально – называют экваториальными (обозначают символом «е»). Каждый атом углерода имеет одну (~100 000 раз в секунду при 25° C) все экваториально связанные атомы водорода становятся аксиальными, а все аксиально связанные – экваториальными. Взаимопревращения в циклогексане протекают настолько быстро, что все атомы водорода циклогексана становятся эквивалентными.
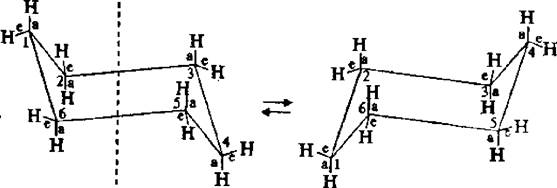
Две конформации «кресла» монозамещенного циклогексана энергетически неравноценны. Более стабильной является конформация с экваториальным положением заместителя. Аксиальное положение заместителя для циклогексана менее выгодно, так как возникает стерическое отталкивание, обусловленное взаимодействием заместителя с аксиально расположенными атомами водорода в положении 3 и 5.
Химические свойства циклоалканов
Для циклоалканов характерны реакции свободно радикального замещения (SR).
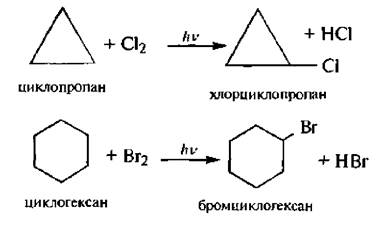
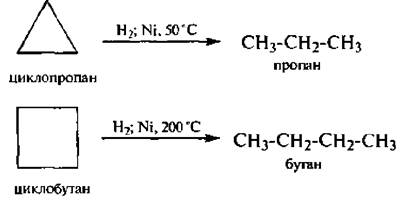
Циклоалканы с малыми циклами проявляют своеобразные химические свойства, связанные с особенностями их строения. Из-за значительного углового и торсионного напряжения трехчленный и, в меньшей степени, четырехчленный циклы являются неустойчивыми. Именно поэтому для циклопропана и циклобутана наряду с реакциями замещения характерны реакции присоединения, сопровождающиеся раскрытием цикла.
1. Гидрировиние
2. Галогенирование
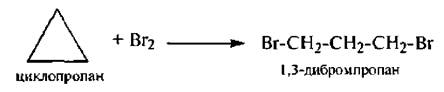
Следует отметить, что с бромом циклобутан вступает в реакцию замещения SR.
3. Гидрогалогеицрование

Представляет интерес реакция присоединения галогеноводородов к алкилзамешенным циклопропана, протекающая в соответствии с правилом Марковникова:
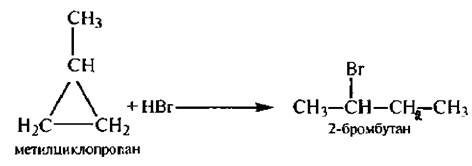
Однако циклобутан не реагирует с галогеноводородами.
Для циклоалканов и их производных характерны реакции сужения и расширения циклов. Данные реакции являются каталитическими и протекают в присутствии кислот Льюиса:
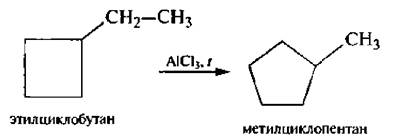
В связи с низкой реакционной способностью и отсутствием функциональных групп идентификация алканов с помощью каких-либо аналитических реакций невозможна. Прежде всего используют физико-химические константы (температуры кипения, плавления; коэффициент преломления, удельное вращение – для оптически активных жидких циклоалканов и др.); определяют процентное содержание углерода и водорода путем сжигания, молекулярную массу и др.; данные физических (инструментальных) методов исследования (ИК-, ПМР-спектроскопии и масс-спектрометрии).
8. АЛКЕНЫ (ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, ОЛЕФИНЫ)
Углеводороды алифатического ряда, содержащие одну двойную связь, называют алкенами.
Двойная связь 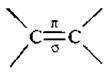 состоит из σ -связи, которая образована sp2-гибридизованными атомными орбиталями (АО) атома углерода и π -связи, образованной негибридизованными р-орбиталями. Строение двойной связи более подробно было рассмотрено ранее. Общая формула алкенов CnH2n.
состоит из σ -связи, которая образована sp2-гибридизованными атомными орбиталями (АО) атома углерода и π -связи, образованной негибридизованными р-орбиталями. Строение двойной связи более подробно было рассмотрено ранее. Общая формула алкенов CnH2n.
|
|