
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние изменения концентрации на смещение химического равновесия
|
|
При изменении концентрации компонентов равновесной системы величина константы равновесия остается неизменной, однако, само равновесие смещается, т.к. при этом создаются благоприятные условия для протекания прямой или обратной реакции.
Согласно принципу Ле Шателье увеличение концентрации любого из участников реакции вызывает смещение равновесия в сторону той реакции, которая приводит к уменьшению концентрации этого вещества. В качестве примера рассмотрим равновесную систему:
SO2(г) + NO2(г) «SO3(г) + NO(г),
для которой 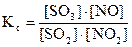
Допустим, что равновесные концентрации реагентов: SO2, NO, NO2 и SO3 при некоторой температуре Т соответственно равны: 0, 2, 0, 4, 0, 1 и 0, 2 моль/л. Тогда
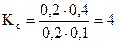
Предположим, что в сосуд, содержащий эту систему, вводится дополнительно 0, 3 моль/л NO2. Если бы при этом не произошло никаких изменений концентраций отдельных компонентов системы и ее температуры, то можно подсчитать, что отношение:
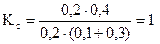
Поскольку величина Kс при фиксированной температуре остается постоянной, очевидно, что концентрации NO и SO3 должны повыситься, а концентрации SO2 и NO2, наоборот, понизиться, чтобы Kс сохранила свое значение, равное 4.
|
|