
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок выполнения работы. Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
|
|
Санкт-Петербург.
Г.
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие теоретические сведения
Гидролиз – процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием не гидролизуются (хлориды, нитраты, сульфаты щелочных металлов, стронция, бария). Различают три типа гидролизующихся солей:
1. Соли, образованные сильной кислотой и слабым основанием, гидролизуются по катиону. В процессе реакции происходит выделение H+; реакция среды – кислая. Продуктами реакции могут являться слабое основание или растворимый гидроксокомплекс (pH< 7).
2. Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону с образованием слабой кислоты или иона кислой соли. В растворах солей этой группы накпливаются ионы гидроксила OH-, в результате чего реакция среды щелочная (pH> 7).
3. Соли, образованные слабой кислотой и слабым основанием, гидролизуются по обоим составляющим их ионам с образованием сразу двух слабых электролитов. Среда в растворах таких солей зависит от относительной силы образующихся в результате гидролиза кислоты и основания, но в целом близка к нейтральной. Степень гидролиза многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами реакции являются труднорастворимые соединения или газы, то гидролиз протекает полностью.
Доля вещества, подвергающаяся гидролизу – степень гидролиза.
Константа гидролиза – характеризует способность вещества подвергаться гидролизу.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
1. Чем слабее кислота или основание, образующееся в результате гидролиза, тем выше глубина протекания процесса.
2. С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
3. Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
4. Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
5. При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Порядок выполнения работы
| № опыта | Формулала соли | Окраска лакмуса | Окраска фенолфталеина | Характер раствора |
| FeCl3 | Оранжевый | бесцветный | Кислый | |
| ZnSO4 | Темно - розовый | бесцветный | Кислый | |
| Al2(SO4)3 | Темно - розовый | бесцветный | Кислый | |
| Na2CO3 | Голубой | фиолетовый | Щелочной | |
| Na2S | Темно - синий | фиолетовый | Щелочной |
Опыт 1. Гидролиз солей.
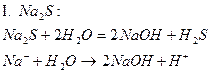
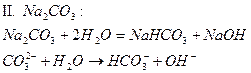
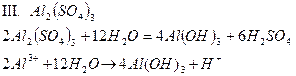
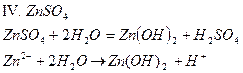

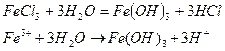
Опыт 4. Взаимное усиление гидролиза при взаимодействии растворов двух кислот.
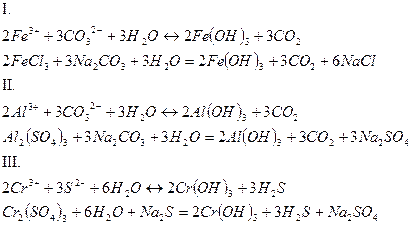
|
|