
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость скорости от концентрации реагирующих веществ
|
|
Скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Это положение иногда называют «основным постулатом химической кинетики», иногда - «законом действующих масс». Математически для реакции, оно может быть выражено уравнением:
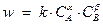
Показатели степени при концентрациях в кинетическом уравнении 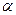 и
и 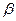 называются порядками реакции по веществу A и B, соответственно (или частными порядками). Сумма частных порядков (
называются порядками реакции по веществу A и B, соответственно (или частными порядками). Сумма частных порядков (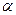 +
+ 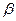 ) называется полным или суммарным порядком реакции.
) называется полным или суммарным порядком реакции.
Коэффициент пропорциональности  в уравнении по предложению Я.Вант-Гоффа называют константой скорости реакции. Численно она равна скорости реакции при единичных концентрациях каждого из реагирующих веществ, поэтому С.Аррениус предложил для
в уравнении по предложению Я.Вант-Гоффа называют константой скорости реакции. Численно она равна скорости реакции при единичных концентрациях каждого из реагирующих веществ, поэтому С.Аррениус предложил для  альтернативное название – «удельная скорость реакции». Величина
альтернативное название – «удельная скорость реакции». Величина  зависит от всех факторов, которые влияют на скорость реакции (например: температуры, природы растворителя, посторонних веществ и т.д.), за исключением концентрации реагирующих веществ. Численное значение константы зависит также от выбора единиц измерения времени и концентрации. Размерность
зависит от всех факторов, которые влияют на скорость реакции (например: температуры, природы растворителя, посторонних веществ и т.д.), за исключением концентрации реагирующих веществ. Численное значение константы зависит также от выбора единиц измерения времени и концентрации. Размерность  определяется тем кинетическим уравнением, по которому производится ее расчет, т.е. зависит от порядка реакции.
определяется тем кинетическим уравнением, по которому производится ее расчет, т.е. зависит от порядка реакции.
Любая химическая реакция представляет собой совокупность элементарных актов химического превращения. Каждый такой акт есть превращение одной или нескольких находящихся в контакте или взаимодействии частиц реагентов (молекул, ионов, свободных радикалов) в частицы продуктов. Простые реакции состоят из однотипных элементарных актов. В зависимости от числа частиц, принимающих участие в реакции, они делятся на мономолекулярные, бимолекулярные и тримолекулярные реакции (т.е. молекулярность реакции равна единице, двум и трем, соответственно). Реакции, при протекании которых осуществляются разнотипные элементарные акты, называются сложными реакциями. К ним относятся обратимые, параллельные, последовательные и др. многостадийные реакции, цепные реакции, сопряженные реакции и др.
Уравнение может быть достаточно строго обосновано лишь для некоторых частных случаев. Например, на основе теории активных соударений – для простых реакций. Только в этом случае частные порядки 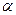 и
и 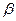 равны стехиометрическим коэффициентам, а суммарный порядок реакции (
равны стехиометрическим коэффициентам, а суммарный порядок реакции (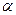 +
+ 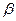 ) равен молекулярности реакции. Для многих сложных реакций (например, для последовательных) также может быть получена зависимость, выражаемая уравнением, однако при этом параметры
) равен молекулярности реакции. Для многих сложных реакций (например, для последовательных) также может быть получена зависимость, выражаемая уравнением, однако при этом параметры 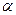 и
и 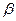 могут не совпадать со стехиометрическими коэффициентами и иметь, в том числе, и дробные значения. В некоторых случаях (например, для цепных реакций) зависимость скорости от концентрации реагентов может быть описана уравнением лишь приближенно в ограниченном диапазоне концентраций.
могут не совпадать со стехиометрическими коэффициентами и иметь, в том числе, и дробные значения. В некоторых случаях (например, для цепных реакций) зависимость скорости от концентрации реагентов может быть описана уравнением лишь приближенно в ограниченном диапазоне концентраций.
Чаще всего 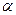 или
или 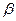 в уравнении бывают равны 0, 1, 2 или 3 и тогда говорят о нулевом, первом, втором или третьем порядке по данному веществу.
в уравнении бывают равны 0, 1, 2 или 3 и тогда говорят о нулевом, первом, втором или третьем порядке по данному веществу.
Для реакций нулевого порядка скорость не зависит от концентрации реагирующего вещества. Обычно это бывает, если концентрация реагента не меняется в ходе реакции, например в гетерогенных реакциях, когда реакция происходит на поверхности. Аналогичная картина будет наблюдаться, когда данный компонент взят в большом избытке. В этом случае его концентрация приблизительно постоянна в ходе реакции. Примером может служить любая реакция, где одним из реагентов является растворитель, а концентрация других реагентов невелика. Часто при изучении кинетики реакций искусственно добиваются того, чтобы порядок по одному из компонентов получился равным нулю. Для этого кинетическую кривую получают при большом избытке (например, стократном) выбранного реагента. Например, если в реакции реагент B взят в большом избытке, то:
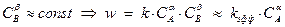 ,
,
где 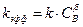 . Нулевой порядок по веществу B в данном случае можно назвать «кажущимся», поскольку, если проводить кинетический эксперимент в других условиях, значение порядка получится равным
. Нулевой порядок по веществу B в данном случае можно назвать «кажущимся», поскольку, если проводить кинетический эксперимент в других условиях, значение порядка получится равным 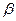 .
.
Похожую ситуацию можно получить и при анализе влияния на скорость катализатора (в данном случае имеется в виду гомогенный катализ). Известно, что добавление катализатора увеличивает скорость реакции, однако из одного кинетического эксперимента (точнее из одной кинетической кривой) порядок по катализатору всегда будет равен нулю, поскольку катализатор в реакции не расходуется и концентрация его остается постоянной. Истинный порядок по катализатору может быть получен только при сопоставлении нескольких кинетических кривых, полученных для разных концентраций катализатора.
В связи с тем, что значение частного порядка реакции зависит от того, как он определяется, в химической кинетике используются понятия «временной порядок» и «концентрационный». При определении временного порядка значения концентрации берутся из одной кинетической кривой в различные моменты времени. Для определения концентрационного порядка (иногда называемого «истинным» порядком) проводят несколько кинетических экспериментов с разными начальными концентрациями (т.е. получают несколько кинетических кривых). При этом анализируется зависимость начальной скорости реакции от начальной концентрации реагента. Временной порядок по реагенту может быть больше концентрационного (например, если продукты ингибируют реакцию, или реакция обратима) или меньше его (в автокаталитических реакциях).
|
|