
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методы определения порядка рекации
|
|
– Экспериментально полученные значения скоростей реакции r 1, r 2, r 3… для соответствующих концентраций С1, С2, С3… наносят на график, построенный в координатах: скорость – концентрация, взятая в 1- ой, 2- ой и т.д. степени и устанавливают, при какой степени точки укладываются на прямой линии. Эта степень и будет искомым порядком реакции. Способ неприменим при дробном порядке.
– Уравнение основного постулата химической кинетики 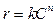 логарифмируют
логарифмируют 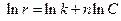 и, подставляя экспериментальные результаты, строят график, на котором по оси ординат откладывают ln r, а по оси абсцисс ln C. Угловой коэффициент прямой и будет искомым порядком реакции. Способ применим для любого порядка, целого или дробного.
и, подставляя экспериментальные результаты, строят график, на котором по оси ординат откладывают ln r, а по оси абсцисс ln C. Угловой коэффициент прямой и будет искомым порядком реакции. Способ применим для любого порядка, целого или дробного.
– Используя время периода полураспада, можно показать, что любая реакция характеризуется выражением: 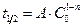 , где А – постоянная для данной реакции величина. Если известен период полураспада для двух различных начальных концентраций
, где А – постоянная для данной реакции величина. Если известен период полураспада для двух различных начальных концентраций 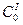 и
и 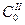 , то
, то
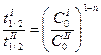 , (11)
, (11)
откуда и определяется n. Ясно, что этот способ неприменим для реакции 1 -го порядка, т.к. для неё 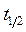 не зависит от начальной концентрации и соотношение (11) обращается в тождество.
не зависит от начальной концентрации и соотношение (11) обращается в тождество.
|
|