
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа. «Определение дифференциального кинетического уравнения»
|
|
«Определение дифференциального кинетического уравнения»
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере реакции взаимодействия серной кислоты H2SO4 и тиосульфата натрия Na2S2O3
Na2S2O3 + H2SO4 ® Na2SO4 + S¯ + Н2SO3.
В результате этой реакции выделяется нерастворимое вещество – сера, поэтому о начальной скорости реакции можно судить по степени помутнения раствора. Одинаковое помутнение реакционной смеси в различных опытах указывает на то, что концентрация образовавшейся серы в этих опытах примерно одинакова. Проводя эту реакцию при различных начальных концентрациях одного из реагентов и постоянной концентрации другого реагента, можно определить величину пропорциональную скорости реакции. Для этого следует определить время t от начала реакции до едва заметного помутнения раствора. Степень помутнения раствора во всех опытах должна быть одинаковой. Если принять концентрацию выделившейся серы за единицу, то начальная скорость реакции будет обратно пропорциональна времени помутнения раствора
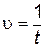 ,
,
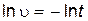 .
.
Дифференциальное кинетическое уравнение для изучаемой реакции выражается следующим образом:
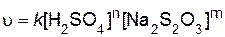 .
.
Так как эта реакция протекает по сложному механизму, то порядки реакции по веществу отличаются от стехиометрических коэффициентов.
Порядок реакции по серной кислоте n и порядок реакции по тиосульфату натрия m определяют, используя логарифмический вид дифференциального кинетического уравнения (пример 5)
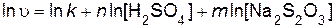 . .
| (7.1) |
При постоянной исходной концентрации серной кислоты оно будет иметь вид
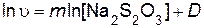 .
.
Порядок реакции по тиосульфату натрия определяют как тангенс угла наклона прямой, построенной в координатах 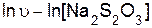
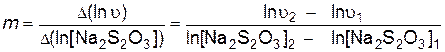 .
. 
Аналогично при постоянной исходной концентрации тиосульфата натрия определяют порядок реакции по серной кислоте - тангенс угла наклона прямой, построенной в координатах 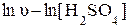
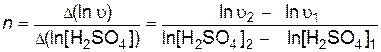 .
.
Подставляя найденные значения порядков n и m в уравнение (7.1), вычисляют константу скорости реакции
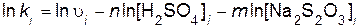 .
.
Варианты работы
| № варианта | I | II | III | IV | ||||||||
| № опыта | ||||||||||||
| H2SO4, ai | ||||||||||||
| Na2S2O3, бi | ||||||||||||
| H2O, вi |
|
|