
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Характеристика состава горючей смеси
|
|
Важной характеристикой горючей смеси является коэффициент избытка окислителя (воздуха)
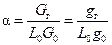 , (1.8)
, (1.8)
где L 0 - стехиометрический коэффициент, т. е. количество окислителя, требующегося для стехиометрического сжигания 1кг горючего; Gг, G0 - соответственно веса горючего и окислителя в смеси.
«Богатая смесь», если a< 1, «бедная смесь», если a> 1. Если a=1, то смесь стехиометрическая.
Пример. Пусть состав горючего характеризуется величинами gCг, gHг, gОг и окислителя gCo, gНо, gОo. Стехиометрические реакции горения:
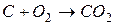 ,
,
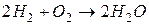 .
.
Если моли выразить в килограммах, то, например, для сгорания 4кг Н 2 требуется 32кг О 2, или на 1кг Н 2 нужно 8кг О 2. Тогда на 1кг горючего кислорода (кг) нужно:
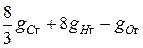 .
.
В 1кг окислителя свободного кислорода содержится
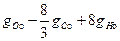 ,
,
где gСo и gНо - весовое содержание С и Н в 1кг окислителя, на сжигание которых необходимо затратить некоторое количество О 2. Следовательно,
 . (1.9)
. (1.9)
Если окислитель - воздух, то gH o=0, gCo=0 и gОo=0, 232, откуда
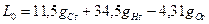 . (1.10)
. (1.10)
Например, для керосина (состав: gC=0, 86 и gH=0, 14) в воздухе L 0=14, 75кг воздуха на 1кг керосина.
1.4. Классификация и общие свойства углеводородов
Нефть и природный газ являются смесью различных углеводородов. Углеводородные горючие классифицируются по гомологическим рядам. Наиболее стабильными являются углеводороды парафинового или метанового ряда. Состав парафинов характеризуется формулой CnH2n+2. Структурная формула нормальных парафинов
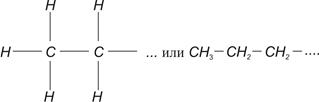
При n> 3 существуют изомеры с разветвленной цепью. Примером могут служить н-бутан и изобутан, структурные формулы которых соответственно имеют вид
СН3 — СН2 — СН2 — СН3 и СН3 — СН — СН3.
ï
СН3
При малых n парафины являются газами при нормальных условиях, например метан СН4, бутан С4Н10. При 5< n< 16 парафины являются жидкостями, например октан С8Н18. При n> 16 парафины находятся в твердом состоянии.
Нафтеновый ряд (или циклопарафины) имеют состав СnН2n. Циклопарафины получаются из парафинов путем удаления из цепи крайних атомов Н и замыкания цепи в кольцо, как это можно видеть на примере циклопропана С3Н6:
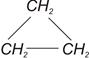
Циклопарафины — это относительно прочные соединения, не реагирующие ни с серной кислотой, ни со щелочами.
Ароматический, или бензольный, ряд имеет состав СпН2n-6. Это непредельные углеводороды циклического строения. Начальным членом ряда является бензол С6Н6:
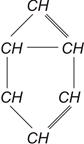
В сложных ароматиках один или несколько атомов Н в кольце замещаются алкильной группой СН3. Примером может служить толуол С7Н8. Ароматические углеводороды характеризуются высокой стойкостью против детонации в двигателях.
Этиленовый, или олефиновый, ряд относится к непредельным углеводородам с двойными связями состава СпН2n. Представителями этого ряда являются: этилен СН2==СН2, пропилен СН3—СН==СН2 и т.д. Олефины легко присоединяют водород и превращаются в предельные углеводороды. Поэтому при длительном хранении в обычных условиях они неустойчивы.
Фракционный состав продуктов переработки нефти характеризуется кривой разгонки, которая представляет собой зависимость между испарившейся долей горючего и температурой смеси.
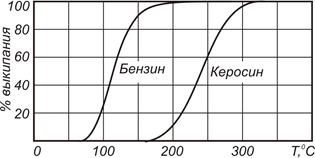
Рис. 1.1. Кривые разгонки для легкого бензина
и тракторного керосина
На рис. 1.1 изображены кривые разгонки для бензина и для тракторного керосина. Видно, что 98% бензина испаряется при температуре 180°С. Для керосина это наступает только при 300°С. При температуре больше 350°С почти все высокомолекулярные углеводороды разлагаются (крекинг) с образованием более легких молекул.
При сгорании молекулы углеводорода конечными продуктами получаются углекислота и вода. Чем сложнее молекула, тем больше энергии заключено во внутренних связях и тем меньше тепловой энергии выделяется при сгорании одной молекулы в расчете на единицу веса. Например, для парафинового ряда теплота сгорания метана СН4 составляет 212, 8ккал/моль, а гексана С6Н14 составляет 1002, 4. Молекулярный вес метана и гексана соответственно равняется 16 и 86, и, следовательно, теплотворные способности (высшие) получаются соответственно 13200 и 11650ккал/кг.
Известно, что в гомологических рядах энергетические интервалы между членами ряда примерно постоянны. В парафиновом ряду присоединение каждой новой метиленовой группы СН2 вызывает увеличение теплоты реакции на 157, 5ккал/моль. Таким образом, теплота реакции углеводородов парафинового ряда СпН2n+2 может быть вычислена [11] по формуле
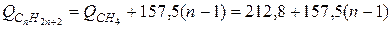 ккал/моль,
ккал/моль,
что дает на единицу веса
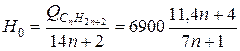 ккал/кг.
ккал/кг.
В [11] приводится также обобщенная формула для расчета высшей теплотворной способности углеводородов типа СпН2n+2а:
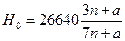 ккал/кг.
ккал/кг.
2. Некоторые сведения из химической кинетики
2.1. Скорость простых химических реакций
Скорость реакции выражается формулой
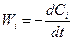 , (2.1)
, (2.1)
где Ci - концентрация одного из исходных компонентов, участвующих в реакции. В зависимости от размерности Ci меняется и размерность Wi. Знак «минус» использован для того, чтобы Wi была положительна, поскольку в процессе реакции Ci уменьшается. Для продуктов реакции Cj. В этом случае
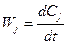 , (2.2)
, (2.2)
Обоснование закона (действующих масс) в том, что реакция осуществляется только при взаимных столкновениях молекул, а частота столкновений пропорциональна концентрациям.
Скорость прямой реакции:
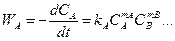 , (2.3)
, (2.3)
где коэффициент k A, зависящий от температуры и вида реакции, называется константой скорости реакции. Размерность k A зависит от mA, mB и от размерности C и t.
Скорость обратной реакции:
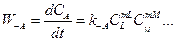 . (2.4)
. (2.4)
где индекс -А показывает, что данная величина относится к обратной реакции.
В смеси исходных веществ и продуктов реакции наблюдаются два противоположных процесса: один сопровождается исчезновением молекул А, а другой, наоборот, их появлением. Суммарное уменьшение концентрации СA будет происходить со скоростью
W=WA - W-A.
Рано или поздно скорости WA и W-A сравняются, так что суммарная скорость станет равной нулю. Наступит состояние химического равновесия. В этом случае
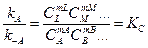 , (2.5)
, (2.5)
где К C - константа равновесия. Зная К C и константу скорости какой-либо реакции, можно найти константу скорости обратной реакции:
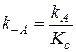 .
.
Если скорость реакции пропорциональна первой степени концентрации только одного из компонентов, например А, а от концентрации остальных компонентов не зависит, то кинетическое уравнение (первого порядка) имеет вид
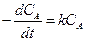 . (2.6)
. (2.6)
Кинетическое уравнение второго порядка:
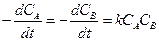 . (2.7)
. (2.7)
Этим уравнением описываются все бимолекулярные реакции, т.е. такие, в которых участвуют две молекулы и реакция происходит при их соударении (mA=mB=1; mС=...=0). Уравнение второго порядка может быть применено и для сложных реакций, если определяющая стадия этой реакции идет по бимолекулярному механизму.
Для реакций третьего порядка уравнение
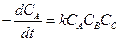 . (2.8)
. (2.8)
Химическая реакция здесь происходит при одновременном соударении трех молекул (тримолекулярная реакция).
Если пренебречь скоростью обратной реакции, то уравнение (2.8) - дифференциальное. Обозначив начальную концентрацию реагирующего вещества через а, после интегрирования при k=const (т. е. для изотермической реакции) получим
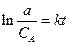 . (2.9)
. (2.9)
Характеристическое время t е - время, в течение которого начальная концентрация а уменьшается в е раз («время релаксации»). Время полураспада t1/2 - время, в течение которого а уменьшается в два раза.
Из (2.9) получим
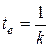 и
и 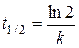 .
.
Значения t е и t1/2 не зависят от начальной концентрации а. Измеряя в эксперименте эти времена, можно однозначно определить константу скорости реакции первого порядка.
Аналогично для реакции второго порядка А+В при начальных концентрациях а и b получим после интегрирования (2.8)
при k=const
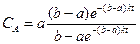 ,
, 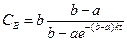
откуда
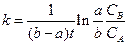 .
.
В частном случае, когда CА= C В= C и а = b, имеем
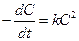 и
и 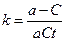 .
.
Отсюда время полураспада 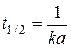 , т. е. зависит от начальной концентрации.
, т. е. зависит от начальной концентрации.
Измерив время полураспада для смеси исходных веществ, взятых в одинаковых концентрациях а 1, и затем повторив опыт для другой концентрации а2, можно сравнить времена t 1 и t 2. Если t 1» t 2, то реакция первого порядка. Если t 1/ t 2» а 2/ а 1, то реакция второго порядка и т. д. Для реакций любого порядка m можно показать, что при одинаковых начальных концентрациях
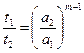 . (2.10)
. (2.10)
|
|