
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Практическая часть. Теория(оформляется с использованием: Лабораторного практикума по курсу химии для технических университетов
|
|
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Теория (оформляется с использованием: Лабораторного практикума по курсу химии для технических университетов, МГТУ, 2005, ч.1, стр.41-53, стр53-62, конспекта лекций, учебника)
- Дайте определение гомогенным химическим реакциям:
- Дайте определение скорости гомогенной химической реакции:
- Приведите математическое выражение скорости химической реакции (4.6) лаб.практ. стр.42):
- Приведите определение основного закона химической кинетики:
- Приведите математическое выражение основного закона (7) лаб.практ.стр.43):
- Дайте определение порядку реакции:
- Дайте определение элементарной реакции:
- Считая нижеприведенную реакцию элементарной, укажитете порядок реакции по H2, по N2 и общий порядок реакции: 3H2 + N2 = 2NH3.
- Дайте определение молекулярности реакции:
- Сформулируйте правило Вант-Гоффа:
- Приведите формулу для расчета температурного коэффициента скорости реакции (4.9) лаб.практ.стр.47):
- Приведите формулу для расчета скорости реакции при известном температурном коэффициенте скорости реакции (4.10) лаб.практ.стр.47):
- Приведите уравнение Аррениуса (4.11) лаб.практ.стр.48):
- Дайте определение энергии активации:
- Приведите формулу для расчета энергии активации при известных константах при двух температурах:
- Дайте определение гетерогенным химическим реакциям (стр.54 лаб.практ.).
- Приведите примеры гетерогенных химических реакций.
- Допишите уравнение гетерогенной реакции. Приведите формулу для расчета скорости этой реакции (5.3) лаб.практ.стр.55):
CaO(к) + CO2(г) =
r =
- Перечислите основные стадии протекания гетерогенных реакций (лаб. практ.стр.55):
- Какая стадия реакции считается лимитирующей?
Практическая часть.
Опыт 1. Зависимость скорости реакции от температуры
Основные понятия: скорость химической реакции r, температурный коэффициент скорости реакции g, энергия активации реакции Е а
Основные расчетные формулы: r = 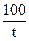 (условная скорость); g =
(условная скорость); g = 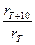 ; Е а =
; Е а = 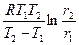
Стехиометрическое уравнение реакции:
Кинетическое уравнение реакции
Таблица. Результаты измерений и расчетов
| № опыта | Температура Т, К | Объем раствора Na2S2O3, мл | Объем раствора Н2SO4, мл | Время протекания реакции t, с | Условная скорость реакции r, с–1 |
Обработка результатов эксперимента (см.стр.51 лаб.пр.):
1.Постройте график зависимости скорости реакции r от температуры t.
2. По полученным данным рассчитайте температурный коэффициент Вант-Гоффа.
3. По полученным данным рассчитайте энергию активации.
Расчеты:
График зависимости r =f (T):
r, с–1
½
½
½
½
½
½
½
½
½
½
½
½ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ® T, К
Выводы: (отмечают влияние температуры на скорость реакции, указывают рассчитанные по результатам измерений средний температурный коэффициент скорости реакции и энергию активации реакции)
|
|