
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетика гетерогенных процессов. Гетерогенными называют реакции, протекающие на границе раздела фаз или в объеме одной фазы гетерогенной системы.
|
|
Гетерогенными называют реакции, протекающие на границе раздела фаз или в объеме одной фазы гетерогенной системы.
К ним относятся химические процессы между веществами, находящимися в различных фазах, горение топлива, окисление металлов кислородом воздуха, процессы на поверхности катализаторов, а так же многие физические процессы: растворение газов и твердых тел в жидкостях, кристаллизация чистых жидкостей и растворов и др.
Подразделяют на три типа процессов:
1) Реакция на поверхности раздела фаз: растворение солей в воде, металлов в кислотах и т.д.
2) Реакция в объеме только одной фазы при диффузии вещества из другой. К таким процессам относят реакции между двумя ограниченно смешивающимися жидкостями, реакции окисления металлов воздухом и т.п.
3) Реакция на поверхности образующейся фазы. Это наблюдается, когда реагируют две твердые фазы или одна твердая фаза превращается в другую.
Одной из особенностей гетерогенных процессов является зависимость их протекания от размеров и состояния поверхности раздела фаз, а также от скорости их относительного движения.
Другая особенность состоит в многостадийности гетерогенных процессов. Кроме основного процесса, протекающего на самой поверхности раздела фаз, обязательны стадии, обеспечивающие подвод к этой поверхности исходных веществ и отвод от нее продуктов.
Доставка вещества к границе между фазами может осуществляться за счет конвекции и диффузии.
Конвекцией называется перемещение всей среды в целом. Конвекция раствора на границе с твердой поверхностью может происходить из-за разной плотности раствора в объеме раствора и вблизи поверхности твердого тела, что вызывается неодинаковой концентрацией или температурой раствора. Это естественная конвекция. Конвекция, созданная перемешиванием, называется вынужденной.
Диффузией называют процесс самопроизвольного перемещения вещества в пространстве, ведущий к выравниваю концентраций в различных точках системы. Движущей силой диффузии является градиент концентрации.
Различают диффузию линейную и пространственную; полубесконечную и ограниченную; стационарную и нестационарную. Линейная диффузия происходит в одном направлении, пространственная — в разных направлениях. Диффузия называется полубесконечной, если фронт диффузии в процессе гетерогенной реакции не успевает достигнуть границы системы; диффузия будет ограниченной, если фронт диффузии достигает границы системы. Под фронтом диффузии понимается граница внутри раствора, где еще не заметны изменения в концентрации, вызванные процессом диффузии.
Кроме доставки вещества могут протекать и другие стадии: дополнительное химическое превращение исходного вещества в растворе (ассоциация или диссоциация молекул, изменение состава компонента), дополнительные химические превращения продукта реакции у поверхности твердого тела (рекомбинация, димеризация, протонизация и т. п.). Каждая из этих стадий может быть лимитирующей, т. е. иметь самую малую константу скорости и оказывать наибольшее сопротивление процессу.
Если определяющей стадией становится сам процесс на поверхности раздела фаз, то принято говорить, что гетерогенный процесс протекает в кинетической области: т.е. константа скорости диффузии значительно больше константы скорости химической реакции. Порядок реакции будет зависеть от природы реагирующих веществ.
В том случае, когда наиболее медленными стадиями становятся стадии подвода или отвода соответствующих веществ путем диффузии, гетерогенный процесс считается протекающим в диффузионной области, т.е. константа скорости химического взаимодействия много больше константы скорости диффузии.
При установившемся равновесии количество вещества, которое подводится к поверхности в единицу времени, равно количеству вещества, которое расходуется в процессе реакции, т.е. в условиях стационарности скорость реакции равна скорости диффузии.
Температура сильнее влияет на скорость химических процессов, чем на диффузию, поэтому гетерогенная химическая реакция при изменении температуры может перейти из кинетической области в диффузионную.
Отличиями диффузионной области от кинетической являются:
а) малые величины энергии активации,
б) влияние перемешивания на скорость реакции в диффузионной области и отсутствие этого влияния в кинетической.
Рассмотрим процессы диффузии, протекающие в одном направлении. На рис. 1 показана граница раздела твердого тела и раствора, δ – толщина слоя раствора, непосредственно примыкающего к поверхности раздела, так называемого диффузионного слоя. В этом слое выравнивание концентраций происходит только за счет диффузии. В остальном объеме раствора выравнивание концентраций может идти и недиффузионным путем (перемешивание, конвекция). Стрелками показаны направления диффузионного потока к поверхности раздела или от нее.
Скоростью диффузии vд называется количество вещества, перенесенное в единицу времени через единицу площади поперечного сечения среды, в которой происходит диффузия. Иногда это количество вещества называют диффузионным потоком Р.
Количество вещества dm, проходящее при диффузии через площадь s за время dt, пропорционально произведению площади, времени и градиента концентрации. Коэффициент пропорциональности D носит название коэффициента диффузии и представляет собой количество вещества, проходящее в единицу времени через единицу площади при градиенте концентрации, равном единице. Размерность коэффициента диффузии см2/с.
Так как диффузия идет в направлении меньших концентраций, то градиент концентрации имеет отрицательное значение, следовательно, количество вещества, проходящее при диффузии, равно
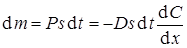 .
.
Это уравнение называется первым законом Фика. Из него следует, что скорость диффузии равна
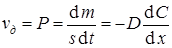 .
.
С увеличением температуры коэффициент диффузии вещества в растворе растет, так как коэффициент вязкости растворителя уменьшается.
Из уравнения Стокса-Эйнштейна для зависимости между коэффициентом диффузии и коэффициентом сопротивления для шара с радиусом r, движущегося в непрерывной среде:
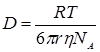 , (3)
, (3)
Несмотря на то, что движение молекулы в растворе довольно сильно отличается от движения шара в непрерывной среде, уравнение (3) достаточно хорошо передает зависимость коэффициента диффузии от разных факторов, в частности от температуры. Учитывая, что коэффициент вязкости экспоненциально зависит от температуры по уравнению 4:
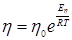
считая приближенно ЕD~Еη получим уравнение 5:
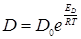 ,
,
где 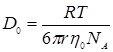 .
.
Температурный коэффициент диффузии 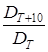 колеблется в пределах 1, 1-1, 5, при этом, чем меньше коэффициент диффузии вещества D, тем больше температурный коэффициент диффузии.
колеблется в пределах 1, 1-1, 5, при этом, чем меньше коэффициент диффузии вещества D, тем больше температурный коэффициент диффузии.
Полагая, что толщина диффузионного слоя не зависит от температуры, для температурного коэффициента константы скорости получим уравнение 7
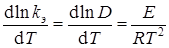 .
.
Чтобы определить скорость диффузии, необходимо знать зависимость между концентрацией, временем и расстоянием.
Рассмотрим диффузию вещества в направлении оси Х в трубке с площадью поперечного сечения s = 1 см2. Вырежем в трубке две площадки s 1 и s 2, находящиеся на расстоянии d х (рис. 2). В единицу времени через площадку s 1 пройдет Р1 вещества. Часть этого вещества может остаться в объеме s 1 dх, вследствие чего через площадку s 2 пройдет меньшее количество вещества Р2. Разность диффузионных потоков Р1 – Р2 вещества накопится в единицу времени в объеме s d х = d х. В результате этого концентрация в объеме d х изменится на величину d C. Увеличение количества вещества в объеме d х за время dt будет равно d C d х. В единицу времени увеличение количества вещества в объеме d х будет равно 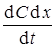 . Следовательно, получаем уравнение 10
. Следовательно, получаем уравнение 10
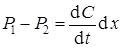 .
.
С другой стороны, согласно первому закону Фика,
 .
.
Сопоставление двух последних уравнений дает
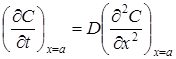 .
.
Следует учесть, что концентрация, а, следовательно, и градиент концентрации меняется в зависимости от времени и расстояния. Поэтому полученное уравнение справедливо для любого, но постоянного сечения, находящегося на расстоянии х = a от диффузионной границы. Это уравнение называется вторым законом Фика. Второй закон Фика показывает зависимость скорости изменения концентрации в слое от градиента концентрации в данном слое.
На рис. 3 показан один из возможных случаев изменения концентрации в различные периоды времени t1, t2 и t3. Положение ординаты на этом рисунке совпадает с границей раздела раствор-растворитель. Отрезок а на оси абсцисс отвечает сечению растворителя (или раствора), находящемуся на расстоянии а от границы начала диффузии. Величина 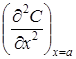 характеризует изменение градиента концентрации в этом слое в момент времени t. Изменение концентрации в слое, находящемся на расстоянии а от начальной точки диффузии, во времени представлено на следующем рисунке.
характеризует изменение градиента концентрации в этом слое в момент времени t. Изменение концентрации в слое, находящемся на расстоянии а от начальной точки диффузии, во времени представлено на следующем рисунке.
Для нахождения vд и vx необходимо знать вид функциональной зависимости C – f (x, t), связанный с конкретными условиями протекания процессов диффузии, которые определяют собой начальные и граничные условия решения дифференциального уравнения второго закона Фика. При решении этого уравнения рассматривают два различных типа диффузионных процессов:
а) стационарное состояние диффузионного потока,
б) нестационарное состояние диффузионного потока.
|
|