
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
|
|
В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных и гетерогенных реакций. По механизму реакции делятся на простые и сложные, поэтому выделяют кинетику простых и сложных реакций.
Основным понятием кинетики реакции является скорость химической реакции. Определение скорости химических реакций имеет биологическое и народно-хозяйственное значение.
Скорость химической реакции определяется количеством вещества, прореагировавшего за единицу времени в единице объема (в случае гомогенных реакций, когда реагирующие вещества находятся в одной фазе) или на единице поверхности раздела фаз (в случае гетерогенных реакций, когда реагирующие вещества находятся в различных фазах).
Скорость реакции характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в функции времени. Уравнение, описывающее зависимость скорости реакции (v) от концентрации (с) реагирующих веществ, называется кинетическим. Скорость реакции чаще выражают в моль/л-с, в биохимии в мг/100мл-с, или в массовой доле, в %/100 мл-с. Различают среднюю скорость реакции в интервале времени и истинную скорость реакции в определенный момент времени. Если в интервале времени t1 и t2 концентрация одного из исходных веществ или продуктов реакции равна соответственно с1 и с2, то среднюю скорость реакции (v) в интервале времени t1 и t2 можно выразить:

Поскольку речь идет в данном случае об убыли концентрации исходного вещества, т.е. изменение концентрации вещества берется в этом случае со знаком «минус» (-). Если скорость реакции оценивается изменением (увеличением) концентрации одного из продуктов реакции, то со знаком «плюс» (+):

По уравнению (2.2) определяют среднюю скорость химической реакции. Истинную (мгновенную) скорость реакции определяют графически. Строят график зависимости концентрации исходного вещества или продукта реакции (Са) от времени (t) - кинетическую кривую реакции Са - f(t) для нелинейного процесса (рис. 2.1).
В каждый момент времени (например, t1) истинная скорость реакции равна тангенсу угла наклона касательной к кинетической кривой в точке, соответствующей данному моменту времени. Согласно графику мгновенная скорость реакции будет рассчитываться по формуле:

В биохимии для описания кинетики ферментативных реакций используется уравнение Михаэлиса- Ментен, которое показывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: E + S ↔ ES → E + P:
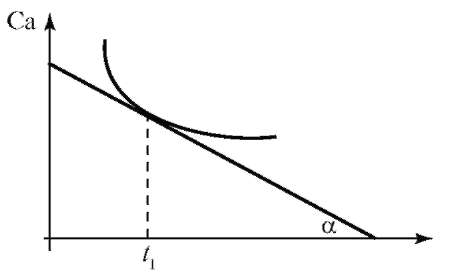
Рис. 2.1. Кинетическая кривая

где Vm - максимальная скорость реакции; Км - константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; S - концентрация субстрата.
Исследование скорости химической реакции позволяют получить информацию о ее механизме. Помимо концентрации скорость реакции зависит от природы реагентов, внешних условий и наличия катализатора.
|
|