
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. 1.1. Классификация реакций
|
|
1.1. Классификация реакций
В химической кинетике реакции разделяются по следующим признакам:
1) по числу частиц, участвующих в элементарном акте реакции (молекулярность);
2) по числу фаз, участвующих в реакции.
Реакции, протекающие на поверхности или у поверхности раздела фаз, называют гетерогенными. Реакции, протекающие в одной фазе – гомогенными;
3) по применению катализаторов: каталитические, автокаталитические и
некаталитические;
4) по сложности: обратимые, необратимые, параллельные, последовательные.
1.2. Скорость химических реакций
Скорость химической реакции определяется изменением количества
вещества в единицу времени в единице объема. Она может быть средней
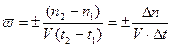 ( 1)
( 1)
или мгновенной при 
 (2)
(2)
где n1, n2 - число молей вещества; V- объем вещества; t1 и t2 -время.
При протекании реакции при постоянстве объема выражения (1) и (2) упрощаются, и скорость определяется изменением концентрации реагирующего вещества в единицу времени:
 (3)
(3)
 (4)
(4)
Скорость реакции всегда положительна, однако при протекании
реакции концентрации исходных веществ уменьшаются, а продуктов
реакции возрастают. В результате производная dC / dt может быть как положительной, так и отрицательной в зависимости от выбора продукта реакции (знак " +") или исходного вещества (" -").
Графический способ определения скорости реакции или показан
на рис. 1.
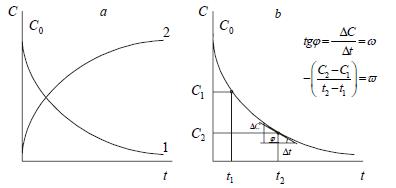
Рис. 1. Кинетические кривые: а - изменение концентрации одного из исходного вещества (1) и одного из продуктов (2) реакции во времени;
b - нахождение скорости реакции ϖ и ω по изменению концентрации одного из исходных веществ во времени.
Скорость реакции как производная от концентрации по времени может быть определена для любого вещества, участвующего в реакции. Например, для реакции, протекающей по уравнению:
aA + bB → cC + dD (5)
где a, b, c и d - стехиометрические коэффициенты, скорость реакции может быть представлена несколькими выражениями:
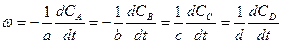 (6)
(6)
Поэтому при определении скорости реакции нет необходимости следить за изменением концентрации всех взаимодействующих веществ. Достаточно знать изменение концентрации во времени одного из веществ, участвующих в реакции согласно уравнению (5).
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, катализаторов, среды (в которой протекает реакция), давления (для реакций, протекающих в газовой фазе), облучения (фотохимические реакции) и т.д. Зависимость скорости реакции от концентрации реагирующих веществ для реакции (5) может быть записана:
 (7)
(7)
где 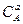 и
и  концентрации веществ А и В в момент времени t;
концентрации веществ А и В в момент времени t;
 - константа скорости реакции.
- константа скорости реакции.
Показатели степени при концентрациях в кинетическом уравнении (7) a и b называются порядком реакции по веществу А и В. Сумма частных порядков a + b = m называется полным или суммарным порядком реакции.
Для характеристики реакции вводят понятие молекулярность реакции,
которое определяется числом частиц, участвующих в одном элементарном акте химических превращений. При этом число молекул образующихся веществ не имеет значения. В зависимости от этого различают реакции: мономолекулярные, бимолекулярные и тримолекулярные. Одновременное столкновение более трех частиц маловероятно.
Порядок реакции является чисто эмпирической величиной. Только для элементарной реакции, протекающей в один этап, он равен ее молекулярности.
Протекание реакции в несколько стадий, является одной из причин расхождения между порядком реакции и ее молекулярностью. Другой причиной расхождения может быть значительный избыток одного из реагентов в реакционной смеси. Тогда концентрация этого реагента остается практически постоянной в ходе реакции, а порядок реакции будет меньше, чем определяемый по стехиометрическому уравнению.
1.2.1. Реакции нулевого порядка.
К ним относятся реакции, скорость которых не зависит от концентрации реагирующего вещества. Такие реакции встречаются, главным образом, среди гетерогенных реакций, протекающих на поверхности вещества, или когда концентрация реагирующего вещества поддерживается постоянной.
Для реакции нулевого порядка скорость может быть записана уравнением:
 (8)
(8)
Разделив переменные, после интегрирования получим:
 (9)
(9)
График в зависимости концентрации от времени будет линейным, а угол наклона будет определять значение константы скорости реакции k (рис.2).
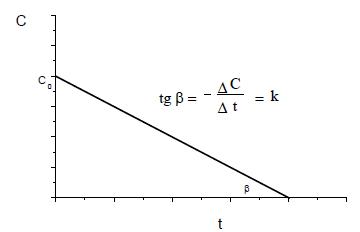
Рис. 2. График зависимости концентрации реагента от времени для реакции нулевого порядка.
Характеристикой химической реакции также является период полураспада 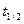 , величина которого равна промежутку времени, в течение которого прореагирует половина исходного количества вещества. Тогда
, величина которого равна промежутку времени, в течение которого прореагирует половина исходного количества вещества. Тогда
 . (10)
. (10)
|
|