
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Модели ферментативного катализа
|
|
Ферменты представляют собой высокоспециализированные белковые катализаторы, ускоряющие течение биохимических реакций в сотни тысяч, миллионы раз. Любое ферментативное превращение начинается со связывания молекул субстратов с активным центром фермента и завершается разрывом этих связей. Гипотеза об образовании лабильного субстрат-ферментного комплекса была впервые высказана в 1902 г. Брауном и Анри. Пытаясь дать количественное толкование явлению насыщения амилазных реакций субстратами Анри в 1904 г. допустил, что реакция образования фермент-субстратного комплекса находится в равновесии и вывел уравнение начальной скорости реакции
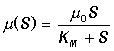
К этому же уравнению пришли в 1914 г. Михаэлис и Метен, а позднее в 1925 г. Бриггс и Холдейн, которые получили аналогичное выражение в предположении квазистационарности реакции образования фермент-субстратного комплекса. В 1943 г. Чанс экспериментально подтвердил образование такого комплекса спектрофотометрическим методом и проследил за изменением его концентрации в ходе реакции, катализируемой гемосодержащим ферментом пероксидазой. В 1930 г. Холдейн распространил теоретические представления о фермент-субстратном комплексе на случай двусубстратных и обратимых реакций и постулировал существование различных фермент-субстратных, фермент-продуктных и фермент-ингибиторных промежуточных комплексов. В настоящее время множество таких комплексов экспериментально изучено.
Учет наличия ингибиторов в системе, в частности в случае, когда в качестве ингибитора выступают молекулы субстрата, образующие как активные, так и неактивные комплексы с субстратом, приводит к более сложным нелинейным выражениям для скорости реакции:
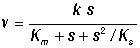
Наличие такого типа нелинейности обусловливает важные свойства ферментативных систем:
- множественность стационарных состояний;
- колебательный характер изменения переменных;
- квазистохастические режимы
· Кинетическая кривая – зависимость концентрации или количества вещества от времени.
· Основные типы элементарных реакций:
· – гомолитические – с образованием и/или разрывом электронных пар;
· – гетеролитические – разрушение и образование связей идёт без образования и разрыва электронных пар;
· – согласованные (концертные) – синхронное превращение нескольких молекулярных орбиталей в новые МО.
11. Как зависит скорость ферментативной реакции от концентрации субстрата?
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой (рис. 2-19). 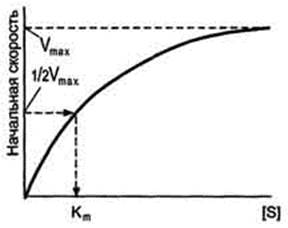 При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
12. Уравнение Михаэлиса-Ментена
соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
| Vmax[S] |
| Km + [S] |
V =
Это уравнение получило название уравнения Михаэлиса-Ментен.
13. Константа Михаэлиса (физический смысл)
соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
14. Ингибирование (общее понятие)
ИНГИБИРОВАНИЕ
(от лат. inhibeo — удерживаю), процесс торможения (подавления) жизненных процессов организма внешними факторами (физического, химического или психического характера).
15. Конкурентное ингибирование (определение, схемы уравнеийхарактеризующих процесс)
В этом случае вещество, близкое по своей структуре к обычному субстрату фермента, соединяется с активным центром фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата.
Поскольку в этом случае ингибитор и субстрат конкурируют за место на активном центре фермента, эту форму ингибирования называют конкурентным ингиЖированием. Для конкурентного ингибирования характерно, что, если концентрация субстрата увеличивается, то скорость реакции возрастает, т. е. это ингибирование обратимо.
Рисунок иллюстрирует один из примеров конкурентного ингибирования.
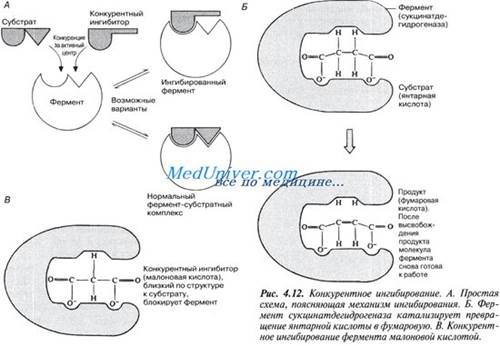
Явление конкурентного ингибирования помогает понять механизм действия некоторых лекарственных препаратов, в частности сульфаниламидов. Цель химиотерапии — уничтожить при помощи тех или иных химических препаратов возбудителя болезни, не повреждая при этом ткани организма-хозяина. Первыми такими препаратами были сульфаниламиды, антибактериальное действие которых было обнаружено в 30-е годы XX в. Во время второй мировой войны их широко применяли для борьбы с раневыми инфекциями. Сульфаниламиды по своей химической природе близки к парааминобензойной кислоте (ПАБК) — необходимому фактору роста многих патогенных бактерий. ПАБК требуется бактериям для синтеза фолиевой кислоты, которая служит у них одним из кофакторов ферментов. Сульфаниламиды ингибируют один из ферментов, участвующих в синтезе фолиевой кислоты из ПАБК.
Животные клетки нечувствительны к сульфаниламидам, хотя им для некоторых реакций и требуется фолиевая кислота. Объясняется это тем, что они используют уже образованную фолиевую кислоту; метаболический путь, который бы обеспечивал ее синтез, у них отсутствует.
|
|