
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Окисление щавелевой кислоты перманганатом калия
|
|
Автокаталитической реакцией является окисление щавелевой кислоты перманганатом калия. Эта реакция протекает по сложному механизму, лимитирующей стадией которого является взаимодействие 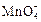 с ионом
с ионом 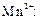 Где лимитирующей стадией сложной химической реакции является та простая реакция, константа скорости, которой оказывает наибольшее влияние на общую скорость сложной реакции
Где лимитирующей стадией сложной химической реакции является та простая реакция, константа скорости, которой оказывает наибольшее влияние на общую скорость сложной реакции
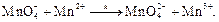 (9)
(9)
Образовавшийся ион Mn3+ далее окисляет щавелевую кислоту с образованием CO2 и Mn2+:
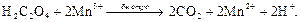 (10)
(10)
Последний процесс, по-видимому, является двустадийным.
Учитывая тот факт, что помимо Mn2+ в реакции образуется MnO2, в системе протекает диспропорционирование 
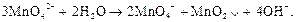 (11)
(11)
Таким образом, записываем вероятную брутто-реакцию:
 (12)
(12)
Скорость реакции равна скорости лимитирующей стадии (9) и пропорциональна произведению концентраций одного из исходных веществ [ 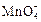 ] на концентрацию одного из продуктов [Mn2+]. Поэтому скорость реакции описывается уравнением, подобным уравнению (2):
] на концентрацию одного из продуктов [Mn2+]. Поэтому скорость реакции описывается уравнением, подобным уравнению (2):
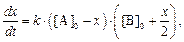
интегрирование которого даст выражения:
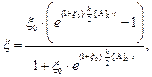 (13)
(13)
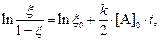 (14)
(14)
где 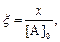
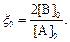
В отсутствие начальной затравки Mn2+ реакция протекает со значительным временем индукции, это обусловлено протеканием медленной некаталитической реакции окисления щавелевой кислоты с образованием Mn2+.При использовании исходной затравки Mn2+ время индукции существенно уменьшается.
Кинетику этой реакции изучают спектрофотометрическим методом. Конечный продукт реакции – MnO2, образующийся в виде мелкодисперсной взвеси, имеет интенсивную полосу поглощения в видимой области спектра с центром при ~ 400 нм, за его образованием следят на длине волны 430 нм, при этом значение коэффициента экстинкции исходного 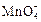 в этой области мало.
в этой области мало.
При наличии в растворе двух поглощающих форм (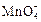 и MnO2) оптическая плотность раствора равна
и MnO2) оптическая плотность раствора равна
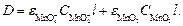 (15)
(15)
До начала реакции величина оптической плотности определяется начальной концентрацией 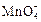 (С 0):
(С 0):
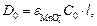
по окончании реакции после полного превращении 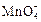 в
в 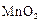 и Mn2+ оптическая плотность равна
и Mn2+ оптическая плотность равна
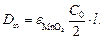
Отсюда 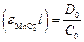 и
и 
Подставляя эти выражения в уравнение (15), имеем
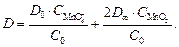 (16)
(16)
Учитывая, что 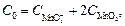 получаем
получаем
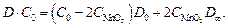 (17)
(17)
Преобразовывая, имеем
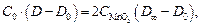 (18)
(18)
откуда
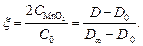 (19)
(19)
Поэтому, регистрируя зависимость оптической плотности раствора от времени, получаем кинетическую кривую накопления MnO2 в результате автокаталитической реакции.
|
|