
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 3. При 500 0С равновесие реакции N2(г) + 3H2(г) ↔ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1,8; [H2] = 7,4; [NH3] = 0,4
|
|
При 500 0С равновесие реакции N2(г) + 3H2(г) ↔ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1, 8; [H2] = 7, 4; [NH3] = 0, 4. Определить: а) исходные концентрации азота и водорода; б) давление в реакционном сосуде в начальный момент и в момент наступления равновесия.
Решение. Обозначим исходные концентрации веществ как [N2]исх и [H2]исх, а часть исходных веществ, прореагировавших к моменту наступления равновесия как [N2]изр и [H2]изр. Равновесные концентрации обозначим как [N2]равн, [H2]равн и [NH3]равн. В начальный момент времени в реакционной смеси присутствуют только азот и водород в начальных концентрациях. В процессе реакции их концентрации убывают, а концентрация аммиака увеличивается. После установления равновесия (когда скорости прямой и обратной реакций равны) в равновесной смеси присутствуют не успевшие прореагировать азот и водород и успевший
образоваться аммиак. Очевидно, равновесные концентрации исходных веществ будут равны разности между их исходными концентрациями и тем количеством, которое прореагировало к моменту равновесия
[N2]равн = [N2]исх - [N2]изр; [H2]равн = [H2]исх - [H2]изр. Равновесные концентрации всех веществ даны в условии задачи, остается определить количества азота и водорода прореагировавших к моменту равновесия. Из уравнения реакции следует, что на каждые 2 моля образовавшегося аммиака затрачивается 1 моль азота и три моля водорода. По условию задачи к моменту равновесия успело образоваться 0, 4 моля аммиака. Для этого потребовалось:
из 3 молей [H2] образуется 2 моля [NH3], а
из Х молей [H2] образуется 0, 4 моля [NH3],
откуда Х = 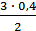 = 0, 6 моля = [H2]изр.
= 0, 6 моля = [H2]изр.
Аналогично находим, что к моменту равновесия израсходовалось [N2]изр = 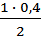 = 0, 2 моля.
= 0, 2 моля.
Рассчитаем исходные концентрации веществ
[N2]исх = [N2]равн + [N2]изр = 1, 8 + 0, 2 = 2, 0 моль/л; [H2]исх = [H2]равн + [H2]изр = 7, 4 + 0, 6 = 8, 0 моль/л.
Для решения этой задачи удобно составить схему:
N2(г) + 3H2(г) ↔ 2 NH3 (г)
Сисх 2, 0 8, 0 0
Сизр 0, 2 0, 6 0
Сравн 1, 8 7, 4 0, 4
С помощью этой схемы можно сделать любые расчеты, учитывая условия задачи;
б) согласно условию, Т = 500 + 273 = 773 К, V = 1л. Исходное число молей реагентов n нач = n нач[N2] + n нач[H2] = 2 + 8 = 10 молей. В состоянии равновесия число молей газов будет равно n равн = n равн[H2] + n равн[N2] + n равн[NH3] = 7, 4 + 1, 8 + 0, 4 = 9, 6 моль.
Подставляя полученные значения в уравнение (P = CRT), рассчитаем давление газовой смеси в начальный момент и в момент равновесия (R=8, 31Дж/моль∙ К=0, 082 л∙ атм/моль∙ град).
Рнач = 10∙ 0, 082∙ 773 = 633, 86 атм;
Рравн = 9, 6∙ 0, 082∙ 773 = 608, 5 атм.
Очевидно, что давление к моменту равновесия уменьшилось, так как реакция идет с убылью числа молей газов.
|
|