
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение задач на гидролиз
⇐ ПредыдущаяСтр 2 из 2
|
|
1. Уравнения диссоциации солей
| ОБЩИЙ ВИД | ПРИМЕР | ||
| формула соли | уравнение гидролиза | формула соли | уравнение гидролиза |
M 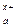 An An 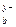
| M 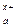 An An 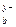 → a Μ x + + b An y – → a Μ x + + b An y –
| Fe 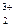 (SO (SO 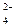 )3 )3
| Fe2(SO4)3 → 2 Fe3+ + 3 SO 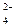
|
2. Определение типов солей
| ОБЩИЙ ВИД | ||||
| формула соли | основание | кислота | ||
| формула | сила (сил./сл.) | формула | сила (сил./сл.) | |
M 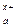 An An 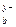
| Μ (OH) x | см. табл. «Сильные кислоты и основания» | H y An | см. табл. «Сильные кислоты и основания» |
| ПРИМЕР | ||||
Fe 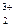 (SO (SO 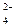 )3 )3
| Fe(OH)3 | сл. | H2SO4 | сил. |
3. Определение типов гидролиза
| ОБЩИЙ ВИД | ПРИМЕР | ||||
| тип соли | сил. осн-ия и сл. к-ты | сл. осн-ия и сил. к-ты | сил. осн-ия и сил. к-ты | сл. осн-ия и сл. к-ты | Fe2(SO4)3 – соль сл. осн-ия и сил. к-ты |
| тип гидролиза | по аниону | по катиону | по обоим ионам | отсутствие гидролиза | по катиону |
4. Краткие ионные уравнения гидролиза
| ОБЩИЙ ВИД | ПРИМЕР | ||||
| тип соли | сил. осн-ия и сл. к-ты | сл. осн-ия и сил. к-ты | сил. осн-ия и сил. к-ты | сл. осн-ия и сл. к-ты | Fe2(SO4)3 – соль сл. осн-ия и сил. к-ты |
| уравнение гидролиза | An y – + H2O ⇄ OH– + HAn(y − 1)− | Μ x + + H2O ⇄ H+ + Μ OH(x –1)+ | — | Μ x + + An y –+ H2O ⇄ Μ OH(x − 1)+ + HAn(y –1)– | Fe3+ + H2O ⇄ H+ + FeOH2+ |
5. Нахождение рН с М растворов солей
| ОБЩИЙ ВИД | ПРИМЕР | |
| тип соли | расчет рН (Ka и Kb –см. табл. «Константы последних ступеней диссоциации…») | Fe2(SO4)3 – соль сл.
осн-ия и сил. к-ты
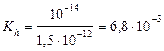 ; ;
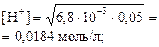 pH = –lg0, 0184 = 1, 74
pH = –lg0, 0184 = 1, 74
|
| сил. осн-ия и сл. к-ты | 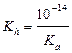 ; ; 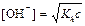 моль/л; pH = 14 + lg[OH–] моль/л; pH = 14 + lg[OH–]
| |
| сл. осн-ия и сил. к-ты | 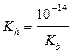 ; ; 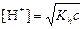 моль/л; pH = –lg[H+] моль/л; pH = –lg[H+]
| |
| сил. осн-ия и сил. к-ты | рН = 7 | |
| сл. осн-ия и сл. к-ты: | ||
а) формула соли Μ  An An 
| 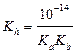 ; ; 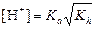 моль/л; pH = –lg[H+] моль/л; pH = –lg[H+]
| |
б) формула соли Μ 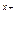 An An 
| 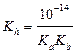 ; ; 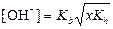 моль/л;
pH = 14 + lg[OH–] моль/л;
pH = 14 + lg[OH–]
| |
в) формула соли Μ 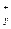 An An 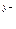
| 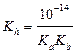 ; ; 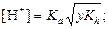 pH = –lg[H+] pH = –lg[H+]
|
6. Определение среды раствора по значению рН
| рН | ОБЩИЙ ВИД | ПРИМЕР | ||
| > 7 | < 7 | рН = 1, 74 < 7 | ||
| Среда раствора | нейтральная | щелочная | кислая | кислая |
|
|