
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Растворение и размывание соленосных отложений.
|
|
Растворение солей обусловлено гидрофильностью ионов, слагающих кристаллическую решетку.
Суммарную энергию гидрофильных ионов соли способных активно взаимодействовать с молекулами воды называют объемной электрической энергией. Объемная энергия, естественно, зависит от гидрофильности и количества ионов (концетрации). Плотность объемной электрической энергии можно определи ть по осмотическому давлению раствора.
В контакте соли с водой происходит «выравнивание» объемной энергии соли и раствора. Происходит двойной массоперенос. Из горной породы в воду диффундируют ионы, а из воды в горную породу – молекулы воды. Происходит с одной стороны увлажнение и разупрочнение соли, с другой- насыщение раствора солью. Растворение соли будет происходить до полного насыщения раствора солью. В насыщенных растворах соль не растворяется. При взаимодействии ионов с молекулами воды образуются гидраты. Вода хороший диэлектрик (диэлектрическая проницаемость при температуре 200 С равна 81 %). Благодаря этому разноименные ионы друг с другом в насыщенном ростворе не взаимодействуют, поэтому в объеме образованного раствора ионы распределяются равномерно количество связанных молекул воды в гидрате зависит от активности (гидрофильности) ионов. При полном насыщении раствора солью или увеличении ее концетрации расстояние между гидратами снижается до расстояния межмолекулярного взаимодействия, образуются кристаллогидраты. Соль выпадает в осадок или адсорбируется на стенках скважин. Например, из насыщенного раствора MgCl2 образуются кристаллогидраты MgCl2*6H2O, из раствора CaCl2 – кристаллогидраты CaCl2*6H2O, CuSO4*5H2O и т.д.
При растворении соли тепловая энергия расходуется на отрыв ионов от кристалла. Эта энергия постоянно пополняется за счет тепловой энергии, выделяющейся в результате гидратирования ионов.
Если при гидратировании выделяется тепловой энергии больше, чем расходуется на отрыв инов наблюдается нагревание раствора. Таким образом теплота гидратации может характеризовать интенсивность взаимодействия молекул воды с ионами соли.
Критерии растворения служат два параметра скорость растворения и растворимость. Скорость растворения – это количество соли, перешедшей в раствор в единицу времени. Растворимость соли характеризуется максимальным количеством соли, способным растворяться в единице емкости воды, т.е. концетрацией насыщенного раствора соли в процентах.
Скорость растворения (растворяющую способность) соли определяют по формуле Фика (см.раздел 4.3
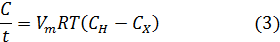
Таким образом в соответствие с формулой (1), скорость растворения соли зависит от вида соли имеющих различную скорость насыщения CH и концетрации соли в растворах. Откуда следует, что с увеличением концетрации соли в растворе скорость растворения понижается, а при СХ=СН снижается до нуля; при полном насыщении раствора солью ее растворение происходить не будет.
Для подтверждения этой зависимости были приведены экспериментальные исследования. Для этого использовались образцы различных солей (одновалентных NaCl т двухвалентных MgCl2), которые опускались в растворы различной концетрации соли. Скорость растворения определялась по формуле:
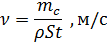
где mc – масса образца соли; ρ – плотность соли; S – поверхность образца.
Результаты замеров скорости растворения солей с одновалентными и двухвалентными катионами показали в табл. 1.
Таблица 13.3
|
|