Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидрокрекинг
|
|
Гидрокрекинг – это один из самых современных процессов, позволяющий получать широкий ассортимент продуктов высокого качества. Он предназначен для получения светлых нефтепродуктов (бензина, керосина, дизтоплива), высокоиндексных низкозастывающих масел и сжиженных газов при переработке под давлением водорода нефтяного сырья с большей молекулярной массой чем целевые продукты. При этом качество продуктов гидрокрекинга в большой степени зависит от свойств катализатора, его гидрирующей и кислотной активности.
12.2.1. Реакции алканов. На многофункциональном катализаторе протекает процесс гидрогенолиза алканов по схеме:
Г
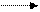 С п Н2 п+ 2 + Н2 С т Н2 т +2 +С п-т Н2(п-т) +2. (12.17)
С п Н2 п+ 2 + Н2 С т Н2 т +2 +С п-т Н2(п-т) +2. (12.17)
Скорость разрыва различных С – С связей зависит от катализатора. На платине эти скорости близки, а на никеле сначала рвутся концевые связи с образованием метана. Высокую активность при гидрогенолизе проявляют также некоторые цеолиты. Реакция протекает гомолитически с участием электронов катализатора. Крекинг и изомеризация алканов происходит также на кислотных и бифункциональных катализаторах.
Основное отличие гидрокрекинга от каталитического крекинга состоит в том, что общая конверсия алканов при гидрокрекинге значительно выше. Это связано с легкостью образования алкенов на гидрирующе-дегидрирующем катализаторе. При этом лимитирующая стадия процесса – инициирование цепи – при гидрокрекинге протекает быстрее, чем в каталитическом крекинге. Продукты гидрокрекинга имеют насыщенный характер, а катализаторы не закоксовываются, т. к. процесс протекает в токе водорода, и промежуточные алкены быстрее гидрируются чем закоксовываются.
12.2.2. Реакции циклоалканов. Незамещенные и метилзамещенные циклоалканы подвергаются в основном гидрогенолизу – расщеплению кольца по С – С связям. На бифункциональном катализаторе с низкой кислотностью разрыв происходит, как правило, по 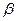 - связи по отношению к заместителю. Например, метилциклопентан при 250 – 270 оС и 2, 1 МПа на алюмоплатиновом катализаторе расщепляется следующим образом:
- связи по отношению к заместителю. Например, метилциклопентан при 250 – 270 оС и 2, 1 МПа на алюмоплатиновом катализаторе расщепляется следующим образом:
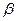 -связь
-связь

 СН3(СН2)2СН(СН3)2
СН3(СН2)2СН(СН3)2
 + Н2
+ Н2 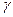 -связь
-связь


 СН3 СН3СН2СН(СН3)СН2СН3 (12.18)
СН3 СН3СН2СН(СН3)СН2СН3 (12.18)

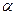 -связь
-связь
 СН3(СН2)4СН3.
СН3(СН2)4СН3.
На катализаторах с высокой кислотностью протекают в основном реакции изомеризации шестичленных циклов в пятичленные и по положению заместителей. Кольцо расщепляется незначительно. Цикланы с длинными заместителями изомеризуются и деалкилируются. Бицикланы превращаются в моноцикланы с высоким выходом пентанов.
12.2.3. Реакции алкенов. Алкены на кислотных центрах превращаются в карбкатионы и вступают в реакции, характерные для них. Они изомеризуются, расщепляются по 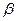 - правилу и насыщаются.
- правилу и насыщаются.
K; H+ + K, изомеризация, 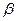 -распад
-распад
 R – CH=CH2 RCHCH3 R+ + алкен или
R – CH=CH2 RCHCH3 R+ + алкен или
 |
Г; Н2 К; - Н+

 RCH2CH3 изоалкен меньшей молекулярной массы сумма низкомолеку-
RCH2CH3 изоалкен меньшей молекулярной массы сумма низкомолеку-
Г; Н2
 лярных алкенов и изоалкенов сумма низкомолекулярных алканов и изоалканов.
лярных алкенов и изоалкенов сумма низкомолекулярных алканов и изоалканов.
Соотношение реакций гидрирования и превращения алкенов по ионному направлению определяется активностью катализатора. Катализаторы с высокой кислотной активностью способствуют образованию низкомолекулярных разветвленных алканов, главным образом изобутана, а катализаторы с высокой гидрирующей способностью благоприятствуют насыщению алкенов и образованию алканов с большой молекулярной масссой и незначительной разветвленностью. Скорость гидрирования снижается с возрастанием числа углеродных атомов в молекуле углеводорода (например, октилен гидрируется со скоростью вдвое меньшей, чем этилен).
12.2.4. Реакции аренов. На катализаторах с высокой гидрирующей активностью арены насыщаются, причем их гидрирование затруднено по сравнению с гидрированием алкенов. Это объясняется тем, что первая стадия этого процесса – образование циклогексадиена – идет с поглощением энергии. Дальнейшее гидрирование кольца протекает уже с выделеним тепла и соответственно с большей легкостью.
Гомологи бензола гидрируются труднее, вследствие пространственных затруднений при адсорбции на катализаторе, вызванных наличием заместителей. Скорость гидрирования гомологов бензола составляет от его скорости: толуола – 0, 6; этилбензола – 0, 4; изопропилбензола – 0, 3; 1, 3, 5-триметилбензола – 0, 2. Скорость гидрирования полициклических конденсированных аренов выше чем бензола, вследствие неравномерного распределения 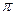 -электронной плотности. Например, скорость гидрирования антрацена до 9, 10-дигидроантрацена в 3, 3 раза выше, чем гидрирование бензола в
-электронной плотности. Например, скорость гидрирования антрацена до 9, 10-дигидроантрацена в 3, 3 раза выше, чем гидрирование бензола в
1, 2-дигидробензол. Особенностью гидрирования полициклов является снижение скорости процесса по мере насыщения колец.
 | |||||||||
 |  |  |  | ||||||







 Н2 (1, 0) Н2 (0, 9) Н2 (0, 45) Н2 (0, 01). (12.19)
Н2 (1, 0) Н2 (0, 9) Н2 (0, 45) Н2 (0, 01). (12.19)
 |  | ||||||||||||||||
 | |||||||||||||||||
 | |||||||||||||||||
 | |||||||||||||||||
 |  |  |  | ||||||||||||||
Здесь в скобках указана относительная скорость реакции.
Вместе с последовательным гидрированием колец возможно расщепление образовавшихся насыщенных колец с выделением алкилзамещенных аренов:







 С3Н7 С3Н7 СН3 С3Н7
С3Н7 С3Н7 СН3 С3Н7




 Н2 Н2
Н2 Н2





 Н2С + (12.20) СН3
Н2С + (12.20) СН3
 СН3.
СН3.
Алкилбензолы далее могут подвергаться гидрогенолизу, преимущественно с последовательным отщеплением метана:



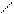



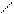


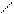
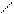


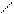
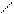



 С3Н7 С2Н5 СН3 Н2 Н2 Н2 Н2. (12.21)
С3Н7 С2Н5 СН3 Н2 Н2 Н2 Н2. (12.21)
– СН4 – СН4 – СН4 – СН4 Н3С Н3С Н3С Н3С
На катализаторах с высокой кислотной активностью превращения аренов во многом схожи с каталитическим крекингом. Незамещенный моноцикл (бензол) стабилен. Метил- и этилзамещенные моноарены изомеризуются по положению заместителей и диспропорционируют. Алкилбензолы с более длинными заместителями деалкилируют. Образовавшиеся алкильные карбкатионы после изомеризации подвергаются 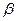 - распаду и насыщаются по схеме гидрокрекинга алканов с образованием низкомолекулярных алканов и изоалканов. Алкилбензолы, кроме того, могут превращаться в тетралин и индан по схеме:
- распаду и насыщаются по схеме гидрокрекинга алканов с образованием низкомолекулярных алканов и изоалканов. Алкилбензолы, кроме того, могут превращаться в тетралин и индан по схеме:


 2R1+ + +
2R1+ + +






 2 (СН2)4R – 2RH (CH2)2CHCH2R + (CH2)3CHR. (12.22)
2 (СН2)4R – 2RH (CH2)2CHCH2R + (CH2)3CHR. (12.22)
Далее процесс продолжается следующим образом:
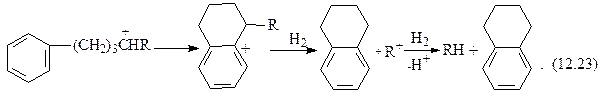
тетралин
|
|
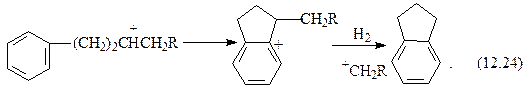
индан
Полициклоарены на кислотных катализаторах гидрируются до моноциклоаренов с различными алкильными заместителями и далее расщепляются как алкилбензолы. Имеет место также образование тетралина и индана.
Сравнение скоростей реакций гидрокрекинга различных классов углеводородов показывает, что гидрирование полициклоаренов до моноаренов или моноцикланов происходит быстро, в отличие от реакций гидрирования моноаренов и моноцикланов. Гидрокрекинг алканов протекает также медленно. Поэтому в продуктах гидрокрекинга идет накопление моноаренов, моноциклоалканов и изоалканов.
12.2.5. Катализаторы процесса. В качестве кислотного компонента – носителя – используют цеолиты, алюмосиликаты, оксид алюминия. Для усиления кислотности можно вводить галогены, другие кислые добавки; проводят также деалюминирование или декатионирование цеолитов.
Гидрирующим компонентом служат Pt, Pd, Ni, Co, Fe, а также оксиды или сульфиды некоторых металлов VI группы Периодической системы, например W, Mo. Для повышения активности металлы восстанавливают водородом, а оксиды сульфидируют. Используют также промотирующие добавки в виде металлов VIII группы Периодической системы, например Re, Rh, Ir, редкоземельные элементы, такие как La, Ce, Nd. Перечисленные металлы применяют в качестве добавок для металлов той же VIII группы. В качестве добавок для оксидов молибдена и вольфрама применяют оксиды кобальта и никеля.
Функцию связующего несут либо кислотные составляющие катализаторной композиции, либо оксиды Si, Ti, Zr, а также Мg- и Zr- силикаты.
Сульфиды и оксиды W и Mo с промоторами – это бифункциональные катализаторы, т. к. они активны и в реакциях гидрирования-дегидрирования, и в окислительно-восстановительных реакциях.
Наилучшие результаты в процессе гидрокрекинга получают при использовании катализаторов с высокой кислотностью и умеренной гидрирующей активностью.
Каталитическими ядами для металлов VIII группы являются элементы
V группы Периодической системы (N, P, As, Sb, Bi) и некоторые элементы
VI группы (O, S, Se, Te). По этой причине гидрокрекинг сырья с высоким содержанием гетеросоединений проводят в две ступени. При этом первой ступенью является гидроочистка с неглубоким крекингом полициклоаренов. Катализаторами здесь служат традиционные катализаторы гидроочистки. Перед второй ступенью сырье должно содержать не более 0, 01 % S и не более 0, 0001 % N. Вторую ступень гидрокрекинга проводят на платиновом и/или палладиевом катализаторе, нанесенном на цеолит типа Y.
При одноступенчатом гидрокрекинге дистиллятных фракций, в которых гетероатомные соединения почти отсутствуют, используют бифункциональные катализаторы на основе металлов платиновой группы (0, 1 – 0, 3 %) или никель в количестве 2 – 10 %. Можно применить композицию, включающую никель или кобальт в количестве 2, 5 – 5 % и молибден или вольфрам в количестве 5 – 15 % в сульфидной форме. В качестве кислотного компонента в этом случае применяют цеолиты, алюмосиликаты или оксид алюминия.
В процессе селективного гидрокрекинга (селектогидрокрекинг) применяют модифицированные цеолиты (модернит, эрионит и др.) с повышенным силикатным модулем. В таких цеолитах поры доступны только нормальным алканам. Применяемые в селектогидрокрекинге катализаторы аналогичны одноступенчатому гидрокрекингу.
12.2.6. Макрокинетика процесса. В первую очередь гидрогенолизу подвергаются гетероатомные соединения, в результате чего выделяются сероводород, аммиак и вода. Кроме того, происходит гидрирование непредельных веществ. Полициклоарены и полициклоалканы гидрируются в алкилзамещенные моноциклы. Алканы расщепляются и изомеризуются. Значительно труднее происходит насыщение последнего ароматического кольца и гидрогенолиз алканов и моноциклоалканов.
Расщепление и изомеризация алканов являются реакциями первого порядка, гидрирование и деструктивное гидрирование – второго порядка. Однако при огромном избытке водорода последние реакции, сопровождающиеся торможением продуктами процесса, также описываются уравнениями первого порядка. Кажущаяся энергия активации гидрокрекинга вакуумного газойля составляет 140 – 250 кДж/моль при 380 – 420 оС.
Тепловой эффект процесса может колебаться в пределах от –208 до +834 кДж/моль сырья.
Расход водорода в процессе составляет 500 – 2000 м3/м3 сырья. При этом, чем выше это соотношение, тем легче продукты процесса. Оптимальными для гидрокрекинга являются температуры в диапазоне 300 – 420 оС. Низкие температуры не обеспечивают высокой скорости процесса. При более высоких температурах реакционная масса обогащена газообразными продуктами. Кроме того, при этом возможна интенсификация коксообразования. Объемная скорость подачи сырья составляет 0, 5 – 2, 0 ч-1. Для дистиллятного сырья давление процесса равно до 7 МПа. Гидрокрекинг тяжелого сырья проводят при 20 – 30 МПа.
В промышленности существует несколько вариантов гидрокрекинга, в зависимости от фракционного состава сырья и от поставленной цели:
а) гидрокрекинг бензиновых фракций предназначен для получения сжиженных газов, изоалканов С 4 – С 5, служащих легким высокооктановым компонентом для моторных топлив и сырьем в нефтехимическом синтезе;
б) гидрокрекинг средних дистиллятов (прямогонных и вторичных), фракции 200–350 оС проводят для получения высококачественных бензинов и реактивного топлива;
в) гидрокрекинг атмосферного и вакуумного газойлей, газойлей коксования и каталитического крекинга ведут для получения бензинов, реактивного и дизельного топлива;
г) гидрокрекинг тяжелых дистиллятов направлен на получение реактивного и дизельного топлив, смазочных масел, малосернистого котельного топлива и сырья для каталитического крекинга;
д) селектогидрокрекинг бензинов ведут с целью повышения октановых чисел бензинов; реактивного и дизельного топлив с пониженными температурами застывания; масел с улучшенными показателями качества, такими как цвет, стабильность, индекс вязкости, температура застывания;
е) гидродеароматизация.
Контрольные вопросы
1. Дайте оценку значимости процессов гидрогенизации в нефтепереработке. Объясните основное назначение этих процессов.
2. Укажите реакции сернистых соединений в процессе гидроочистки.
3. Укажите реакции азотистых соединений в процессе гидроочистки.
4. Укажите реакции кислородных соединений в процессе гидроочистки.
5. Представьте реакции углеводородов в процессе гидроочистки.
6. Какие катализаторы применяются в процессах гидроочистки? Приведите каталитические композиции, применяемые в гидроочистке, и соотношение компонентов в ней.
7. Объясните макрокинетику процесса гидроочистки.
8. Изложите цель и условия процесса гидроочистки светлых фракций.
9. Изложите цель и условия процесса гидроочистки темных дистиллятов и нефтяных остатков.
10. Представьте реакции алканов в процессе гидрокрекинга.
11. Представьте реакции циклоалканов в процессе гидрокрекинга.
12. Представьте реакции алкенов в процессе гидрокрекинга.
13. Представьте реакции аренов в процессе гидрокрекинга.
14. Какие каталитические композиции применяют при гидрокрекинге?
15. Какова макрокинетика процесса гидрокрекинга?
16. Изложите цель и возможности гидрокрекинга бензиновых фракций.
17. Изложите цель и возможности гидрокрекинга тяжелых газойлей.
18. Изложите цель и условия проведения процессов селективного гидрокрекинга и гидродеароматизации.
19. Оцените достоинства гидрокрекинга по сравнению с другими вторичными процессами нефтепереработки.
|
|