
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Л е к ц и я № 3
|
|
Очистка сточных вод методом коагуляции
П л а н
1. Общая характеристика метода коагуляции.
2. Гетерокоагуляционный метод очистки СВ.
3. Факторы, влияющие на процессы коагуляции.
3.1. Содержание коллоидных частиц.
3.2. Температура.
3.3. Эффективность перемешивания.
3.4. рН раствора.
3.5. Растворённые в воде примеси.
3.6. Степень насыщения (концентрация коагулянта).
4. Основные коагулянты и их характеристика.
4.1. Соли алюминия.
4.2. Соли железа.
5. Коагуляционные методы очистки.
5.1. Контактная коагуляция.
5.2. Коагуляция под воздействием физико-химических
факторов.
5.3. Электрохимическая коагуляция.
Известные методы механической очистки позволяют выделить из сточных вод частицы крупностью ~ 10-5 м. Однако в сточных водах содержатся и мелкодисперсные и коллоидные частицы размером 10-9–10-7 м. Для очистки сточных вод от таких примесей используют методы коагуляции и флокуляции.
1. Общая характеристика метода коагуляции
Коагуляция – это процесс укрупнения дисперсных частиц в результате их взаимодействия и объединения в агрегаты.
Прежде, чем говорить о коагуляции как методе очистки СВ, давайте вспомним состояние коллоидных частиц в растворе, а именно, применительно к сточным водам.
Концентрация коллоидной фазы в сточных водах невелика, поэтому сточные воды могут быть отнесены к свободнодисперсным коллоидным системам. Присутствующие обычно в сточных водах органические вещества, электролиты, ПАВ существенно влияют на устойчивость дисперсных систем, а так же на процессы и коагуляцию.
Коллоидные частицы обладают большой удельной поверхностью и в результате адсорбируют находящиеся в воде ионы. Процессы адсорбции зависят в первую очередь от природы частиц. Поскольку ионы заряжены, то вследствие их адсорбции образуется коллоидная частица, имеющая заряд. Ионы, которые адсорбировались, называются потенциалоопределяющими ионами. К заряженной частице под действием сил электростатического взаимодействия притягиваются противоионы, имеющие противоположный заряд.
Образуется двойной слой ионов. Этот слой состоит из двух частей. Первая часть образована противоионами, расположенными вблизи поверхности (так называемыми ассоциированные противоионы). Размеры этого слоя соизмеримы с размерами молекул. Вторая часть противоионов образует подвижный диффузный слой.
m MN → m M+ + m N-,
гранула
ядро { mM+ (m – x) N-}-x x N- } - мицелла
коллоидная частица
Между коллоидной частицей и диффузным слоем существует разность потенциалов, так называемый ξ – потенциал (дзета) или электрокинетический.
Все частицы данного коллоида сорбируют преимущественно ионы одного знака и оказываются частицами одного знака, между ними возникают силы электростатического отталкивания.
С другой стороны, частицы коллоидов находятся в воде под действием диффузионных сил, обусловленных броуновским движением.
Под их влиянием частицы стремятся равномерно распределиться во всём объёме. При достаточно мелких размерах коллоидных частиц силы диффузии преобладают над силами тяжести и частицы остаются во взвешенном состоянии. Для того, чтобы произошло осаждение этих частиц, необходимо их укрупнение за счёт слипания, которому мешает электрический заряд.
Одновременно между частицами действуют силы Ван-дер-Ваальса – молекулярные силы взаимного притяжения. Эти силы проявляются лишь при небольшом расстоянии между частицами и убывают при увеличении расстояния между ними. Однако необходимость большой кинетической энергии частиц для преодоления сил столкновения снижает вероятность слипания частиц и коагуляцию коллоида, коллоидная система сохраняет свою агрегативную устойчивость.
Наиболее эффективный способ снижения агрегативной устойчивости коллоидной системы – это снижение электрического заряда частиц, т. е. уменьшение ξ – потенциала.
Существуют следующие методы снижения ξ – потенциала коллоидной системы.
1) Увеличение в воде концентрации электролита.
При этом увеличивается концентрация в растворе противоионов, которые понижают заряд гранулы и тем самым снижают ξ – потенциал.
Способность электролита вызывать коагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом, противоположным заряду коллоидных частиц.
Таблица 1 - Относительная коагулирующая способность электролитов
| Электролит | Относительная коагулирующая способность для частиц, заряженных | |
| положительно | отрицательно | |
| NaCl | ||
| Na2SO4 | ||
| Na3PO4 | ||
| AlCl3 | ||
| FeCl3 | ||
| Fe2(SO4)3 |
При добавлении к раствору электролита постепенно снижается ξ – потенциал иногда до ξ = 0. Oднако дальнейшее увеличение концентрации в растворе электролита может привести к перезарядке коллоидных частиц, что приведёт к возрастанию ξ – потенциала и возрастанию устойчивости коллоида.
При проведении коагуляции путём добавления электролита следует иметь в виду, что чрезмерное увеличение дозы реагента может ухудшить коагуляцию коллоидов.
2) Коагуляцию коллоидов, загрязняющих воду, можно вызвать добавлением другого коллоида, частицы которого имеют заряд, противоположный заряду загрязняющих частиц. В результате, вследствие действия сил электростатического напряжения частиц добавляемого коллоида и заряженных частиц происходит их слипание, укрупнение и осаждение. При осуществлении процесса коагуляции по этой схеме количество добавляемого к воде коллоида коагулятора должно быть эквивалентно по электрическим зарядам и общему количеству зарядов частиц коагулируемого коллоида.
Такой метод коагуляции коллоидов, загрязняющих воду, под действием других коллоидов называется гетерокоагуляцией.
2. Гетерокоагуляционный метод очистки
Гетерокоагуляция – это взаимодействие коллоидных и мелкодисперсных частиц с агрегатами, образующимися при введении в очищаемую воду коагулянтов.
Это основой метод коагуляционной очистки сточных вод.
В качестве коагулянтов применяют соли, образованные слабыми основаниями 2-х и 3-х валентных металлов и сильной кислотой. Вследствие гидролиза коагулянты в воде образуют гидроксиды металлов, которые быстро оседают под действием силы тяжести. Хлопья гидроксидов улавливают коллоидные и взвешенные частицы и агрегируют их. Коллоидная частица сточной воды имеет слабый отрицательный заряд, а хлопья коагулянтов – слабый положительный заряд, между ними возникает взаимное притяжение.
Образование хлопьев коагулянта вследствие гидролиза идёт по следующей схеме:
Me+3 + HOH Û MeOH+2 + H+;
MeOH2+ + HOH Û Me(OH)2+ + H+;
Me(OH)2+ + HOH Û Me(OH)3 + H+,
где Me+3 = Al3+, Fe3+
Гидроксиды металлов являются малорастворимыми соединениями, их концентрация в воде значительно выше их растворимости, т. е. раствор оказывается пересыщенным и поэтому коагулянт выделится в осадок из пересыщенного раствора в твёрдую фазу в виде частиц коллоидной степени дисперсности.
Процесс осаждения протекает в 3 стадии.
I стадия – стадия кристаллизации (инкубационный период) – адсорбция аморфных частиц коагулянта на поверхности частиц примесей сточной воды.
II стадия – коагуляция или рост зародышей.
III стадия – старение твёрдой фазы – аморфные частицы твёрдой фазы превращаются в кристаллы, которые затем агрегируются.
3. Факторы, влияющие на процессы коагуляции при
очистке сточных вод
На эффективность процесса очистки сточных вод методом коагуляции существенное влияние оказывает скорость коагуляции, которая зависит от содержания коллоидных частиц (концентрации примесей); температуры; эффективности перемешивания; рН раствора; растворённых в воде примесей.
3.1 Содержание коллоидных (взвешенных) частиц
в сточной воде
С увеличением концентрации примесей в воде увеличивается скорость коагуляции (т. к. на этих частицах образуются зародыши). При невысоком содержании примесей образуется мало центров кристаллизации и коагуляция идёт плохо: образуются мелкие хлопья, которые не осаждаются в отстойниках, а уносятся с осветлённой водой. В этих случаях для уменьшения дозы коагулянта и повышения эффективности очистки в очищенную воду добавляют небольшие количества тонкодисперсных порошков бентонитовой глины (химический состав Na (Mg, Al2) [Si4O10](OH)2 . 4H2O] - глины, образующиеся при извержении вулканического пепла), магнезита MgCO3, мела. Частицы этих порошков наряду с примесями воды служат центрами образования зародышей при кристаллизации коагулянта.
С этой же целью используют метод рециркуляции осадка – часть осадка, полученного в результате коагуляции, смешивают с исходной водой.
3.2 Температура
С увеличением температуры увеличивается скорость кристаллизации коагулянта. Увеличивается интенсивность броуновского движения, а, следовательно, и вероятность столкновения частиц возрастает, возрастает скорость коагуляции и уменьшается продолжительность инкубационного периода.
При невысоких температурах образуются мелкие медленно оседающие хлопья, увеличивается необходимое количество коагулянта, эффективность очистки падает.
Электронно-микроскопические исследования показали: при температуре (80–90)°С частицы Al(OH)3 сразу же образуют мелкокристаллический осадок, при температуре 20°C – процесс заканчивается через сутки.
3.3 Перемешивание
Перемешивание приводит к возрастанию вероятности столкновения частиц, повышается скорость кристаллизации коагулянта и уменьшается продолжительность инкубационного периода.
Однако при значительном возрастании скорости перемешивания наблюдается обратный процесс. Наблюдается разрушение образовавшихся крупных хлопьевидных агрегатов из аморфных и мелкокристаллических частиц.
Таким образом, перемешивание оказывает влияние на всех стадиях коагуляционной очисти СВ.
3.4 рН раствора
Из уравнения гидролиза видно, что с увеличением степени гидролиза рН раствора падает. Следовательно, для того, чтобы сдвинуть равновесие вправо, нужно увеличивать рН раствора.
Поэтому для полного и быстрого протекания гидролиза необходимо подщелачивать очищаемую воду перед введением коагулянта для связывания выделяющихся при гидролизе Н+- ионов.
Подщелачивающее действие могут выполнять гидрокарбонат-ионы НСО3-, присутствующие в воде, или специальные реагенты – известковое молоко Са(ОН)2, кальцинированная или каустическая сода.
3.5 Растворенные в воде примеси
Процесс коагуляции определяется степенью гидролиза коагулянта, которая, в свою очередь зависит от солевого состава сточной воды.
Протекание коагуляции определяет анионный состав растворенных в воде солей:
- если в сточной воде имеется одноимённый с коагулянтом анион, это приводит к ускорению процесса кристаллизации, поскольку уменьшается инкубационный период;
- если в очищаемой воде не содержится одноимённый с коагулянтом анион, то скорость коагуляции уменьшается;
Например, если в сточной воде содержится анион Cl- (коагулянт Al2(SO4)3), то образуется большое количество мелких хлопьев, снижается устойчивость коллоидных частиц.
Органические вещества также влияют на протекание процесса коагуляции:
небольшое их количество в сточной воде благоприятно сказывается на процессе коагуляции (ускоряется процесс старения Al(OH)3);
большие количества органических веществ снижают интенсивность коагуляции: эти вещества адсорбируется на растущих кристаллах коагулянта, образуя плёнки, что тормозит рост кристаллов.
Поверхностно-активные вещества (ПАВ) оказывают отрицательное влияние на протекание коагуляционных процессов.
(ПАВ – это вещества, снижающие поверхностное натяжение жидкости, они способны адсорбироваться на поверхности раздела фаз; состоят из углеводордного радикала до C20 и полярной группы - -ОН, -СООН, -NH2, SО3).
При содержании в воде ПАВ снижается вероятность образования зародышей новой фазы и способность их роста, что обуславливает повышение дисперсности и ухудшает эффект очистки.
3.6 Концентрация коагулянта
Скорость коагуляции зависит от числа коллоидных частиц в сточной воде и степени насыщения (дозы коагулянта).
Если считать, что кристаллизация коагулянта, добавленного в сточную воду, происходит только на коллоидных частицах, то процесс кристаллизации может быть описан следующим дифференциальным уравнением:
3 _______
d α / d τ = 3 √ ρ no φ (α o- α)2/3 λ,
где α o и α – абсолютное начальное пересыщение и пересыщение к моменту времени τ;
ρ – плотность кристаллов;
no – число коллоидных частиц примеси в единице объёма;
φ – коэффициент формы частиц;
λ – линейная скорость кристаллов при пересыщении.
Зависимость скорости коагуляции от концентрации электролита-коагулянта может быть представлена следующим образом (см.рисунок 3.1).
Скорость
коагуляции
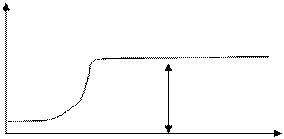 |
ψ =1
Концентрация
Рисунок 3.1 – Зависимость скорости коагуляции
от концентрации электролита - коагулянта
 |
С, мг/дм3
Тонкодисперсная взвесь
Грубодисперсная
С взв., мг/дм3
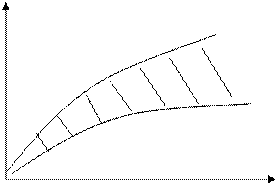
Рисунок 3.2 – Зависимость скорости коагуляции
от содержания взвешенных веществ
При малых концентрациях электролита эффективность соударения частиц близка к нулю Ψ = 0.
Эффективность соударения Ψ – отношение числа столкновений, окончившихся слипанием, к общему числу столкновений.
При Ψ = 1 наступает быстрая коагуляция, при которой все столкновения частиц заканчиваются образованием агрегатов.
Доза коагулянта зависти и от содержания в воде взвешенных частиц и степени их дисперсности: с увеличением количества примесей доза коагулянта растёт (рис.3.2).
4. Коагулянты и их характеристика
Для очистки сточных вод чаще всего применяются минеральные коагулянты. Это соли алюминия или железа.
4.1. Соли алюминия
В качестве коагулянтов находят применение следующие соединения алюминия:
Al2(SO4)3 . 18H2O –сульфат алюминия (глинозем);
NaAlO2 – алюминат натрия;
Al2(OH)5Cl – оксихлорид алюминия;
KАl(SO4)2 . 12H2O и NH4Al(SO4)2 . 12H2O – квасцы;
В результате гидролиза образуется амфотерные хлопья Al(OH)3, которые выпадают в осадок при рН = 4÷ 12, 5.
В зависимости от состава сточных вод процесс коагуляции солями алюминия проводят при рН < 5 – 7, 5. Именно в этом интервале присутствует в основном соединение неионогенного типа Al(OH)3; рН < 5 – катионного типа Al2(OH)24+; рН > 7, 5 – анионного типа Al(OH)4-.
Чаще всего используют Аl2(SO4)3 как сухой порошок или 5 %-ный раствор (растворимость сульфата алюминия 362 г/л).
Коагуляции способствуют соли жёсткости, поскольку протекает реакция
Аl2(SO4)3 + 3Са(НСО3)2 → 2Al(OН)3 + 6CO2 + 3CaSO4 ↓.
Алюминат натрия применяют как сухой порошок или 45 %-ный раствор. NaAlO2 при рН = 9, 3÷ 9, 8 образует быстро осаждающиеся хлопья.
В большинстве случаев используют смесь
Аl(SO4)3: NaAlO2 = (10: 1) ÷ (20: 1).
В этом случае
6 NaAlO2 + Al2(SO4)3 + H2O → 8Al(OH)3 + 3Na2SO4.
Совместное применение этих солей даёт возможность повысить эффект осветления, увеличить плотность и скорость осаждения хлопьев, расширить область рН очищаемой воды.
4.2. Соли железа
В качестве коагулянтов находят применение следующие соединения железа:
сульфаты Fe2(SO4)3 . 2H2O, Fe2(SO4)3 . 3H2O, FeSO4 . 7H2O,
хлорид железа (хлорное железо) FeCl3.
Хлорное железо применяют в сухом виде или (10÷ 15) %-ного раствора, растворимость в воде 919 г/л. сульфаты используют в виде порошков. Коагуляция протекает в широком диапазоне рН – от 3, 5 до 11, 0.
Преимущества солей железа как коагулянтов по сравнению с солями алюминия:
o лучшее действие при низких температурах;
o применение в большем интервале рН.;
o большая плотность и крупность хлопьев;
o применение для вод с более широким диапазоном состава;
o способность удалять запахи и привкусы, обусловленные присутствием H2S, удалять ионы марганца, сорбировать соединения меди и мышьяка, катализировать окисление фенолов, сахара и др. органических соединений.
Недостатки солей железа как коагулянтов:
o возможность Fe3+ образовывать окрашенные комплексы с органическими лигандами;
o гигроскопичность;
o трудность в получении;
o дороговизна (в 3 – 4 раза дороже солей алюминия);
o менее развитая поверхность хлопьев.
Лучшие результаты получаются при использовании смеси солей алюминия и железа. Оптимальное соотношение Al2(SO4)3: FeCl3 = 1: 1 (1: 2) на безводные соли.
В процессе коагуляции идёт адсорбция коллоидного гидроксида Al(OН)3 на хлопья Fe(OH)3. В результате происходит совместное хлопьеобразование и ускорение осаждения хлопьев.
Преимуществом применения смесей солей алюминия и железа является увеличение эффективности очистки при низких температурах.
Недостатком являются трудности, связанные с приготовлением и хранением коагулянта. При нарушении технологического режима возможно повышение содержания ионов железа в очищаемой воде воде.
|
|