
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Куликов, А. А.
|
|
Отдел научно-технической информации и образовательной
деятельности СПбНИИЛХ,
(зав. отделом кандидат технических наук Н. А. Маятина),
доцент Санкт-Петербургского государственного университета
сервиса и экономики, кандидат технических наук В. Ф. Бадах
УДК
Куликов, А. А.
Топливо. Тепловой баланс котельного агрегата: учебное пособие для студентов очной и заочной форм обучения / А. И. Куликов [и др.]. – СПб.: СПбГЛТУ, 2012. – ____ с.
ISBN 978-5-9239-
Представлено кафедрой теплотехники и теплосиловых установок.
В первой части пособия детально рассмотрены основные характеристики топлива. Приведен подробный вывод всех формул, относящихся к расчетам: объема воздуха на горение; объема образующихся дымовых газов; температуры горения.
Во второй части применен оригинальный метод для вывода уравнения теплового баланса котельного агрегата. Все окончательные расчетные формулы строго и последовательно выведены из первого закона термодинамики.
Учебное пособие предназначено для студентов очной и заочной форм обучения.
Библиогр. 19 назв. Табл. 6. Ил. 10.
Темплан 2012 г. Изд. № 97.
ISBN 978-5-9239-  Ó СПбГЛТУ, 2012
Ó СПбГЛТУ, 2012
1. ВИДЫ ТОПЛИВА
Теплотехнические установки (ТТУ) – это устройства, которые потребляя топливо, обеспечивают достижение определенного полезного эффекта.
Например, в теплосиловых установках (ТСУ) полезный эффект – это механическая работа, которую можно, в частности, использовать для получения электроэнергии на тепловой электрической станции (ТЭС).
Комплекс оборудования, обеспечивающий переход одного вида энергии в другой, называется станциями.
В котельных агрегатах (КА) полезный эффект от использования топлива состоит в получении горячий воды или водяного пара в насыщенном или перегретом состояниях.
Топливом называется вещество, с помощью которого можно получить технически полезную энергию.
По механизму выделения энергии топливо разделяют на две группы: ядерное и органическое.
По происхождению – на природное (уголь, нефть, природный газ, сланцы, торф, древесина и т. п.) и искусственное (бензин, керосин, кокс и т. п.), которое получается путем переработки природных топлив.
По агрегатному состоянию – на твердое, жидкое, газообразное.
2. Теплотехнические характеристики
К теплотехническим характеристикам топлив относятся:
· химический состав топлива;
· теплота сгорания топлива;
· влажность;
· выход летучих и кокса;
· зольность;
· свойства коксового материала.
Определение этих характеристик является задачей технического анализа топлива.
Зольность. Минеральные примеси состоят из различных минеральных веществ, входящих в состав твердого топлива.
Основные минеральные примеси состоят из алюмосиликатов (кремнезем SiO2, глинозем Al2O3, глина), сульфидов (в основном железный колчедан FeS2), карбонатов (CaCO3, MgCO3, FeCO3), сульфатов (CaSO4, MgSO4), окислов металлов, фосфатов, хлоридов, солей щелочных металлов.
В зависимости от происхождения различают три вида минеральных примесей – первичные, вторичные и третичные.
Первичные примеси попали в топливо вместе с углеобразователями, они связаны с органической массой топлива. Количество первичных примесей, как правило, невелико. Они распределяются в топливе равномерно по всей массе. Удалить первичные примеси из топлива невозможно.
Вторичные примеси были внесены в топливо в процессе углеобразования ветром и водой в виде наносов. Распределены они в топливе менее равномерно, иногда в виде тонких прослоек, но удалить их также практически невозможно. Поэтому первичные и вторичные примеси считаются внутренними примесями.
Третичные примеси попадают в топливо при его добыче, транспортировке и хранении и представляют собой породы из внешнего минерального окружения вырабатываемого пласта. Распределены они в топливе неравномерно и достаточно легко отделяются. Поэтому третичные примеси являются внешними примесями.
В процессе горения при высоких температурах минеральные примеси претерпевают различные физико-химические преобразования, в результате чего получается твердый негорючий остаток, который называется золой.
Хотя золы обычно получается по массе несколько меньше, чем минеральных примесей в исходном топливе, для теплотехнических расчетов пользуются процентным (по массе) содержанием золы – зольностью (А).
Для определения зольности топлив пользуются стандартной методикой (прил. 1).
Важными свойствами золы являются абразивность и плавкость.
Зола с высокой абразивностью вызывает сильный износ конвективных поверхностей парогенераторов.
В топочной камере при высоких температурах часть золы расплавляется, образуя раствор минералов, называемый шлаком.
Шлак удаляется из топки в жидком или гранулированном состоянии. По характеристикам плавкости золы энергетические угли подразделяются на три группы в соответствии с температурой плавления золы t З:
1) с легкоплавкой золой (t з ≤ 1350°С);
2) с золой средней плавкости (t з = 1350…1450°С);
3) с тугоплавкой золой (t з > 1450°С).
Легкоплавкая зола приводит к зашлаковыванию горящего слоя топлива, заливает отверстия колосниковой решетки, застывает в них, затрудняет подвод воздуха в зону горения, а также налипанию размягченной, расплавленной летучей золы на стенки кипятильных труб котла. Это загрязняет поверхность нагрева, ухудшает теплопередачу в пучках труб и вызывает необходимость очистки труб котла и стенок топки. Причем жидкий шлак может вступать в химическое взаимодействие с огнеупорной кладкой и обмуровкой котла, вызывает их разрушение.
Содержание золы в рабочей массе топлива колеблется от 0, 3…60 %. Минимальное количество золы содержится в древесном топливе – 0, 6…1, 8 %, наибольшее – в сланцах (46…60 %), которые поэтому сжигаются преимущественно в пылевидном состоянии.
При сжигании топлива в виде мелких фракций (частиц угольной и сланцевой пыли, опилок и др.) происходит значительное загрязнение воздушного бассейна окружающей местности вследствие большой доли выноса золы (до 80…90 %). Это ухудшает санитарные условия жизни населения прилегающих к ТЭЦ жилых кварталов рабочих поселков и городов.
Кроме того, запыленность воздуха может снижать качество продукции некоторых производств, как например, сортность бумаги, досок и пр.
Зная процент содержания и свойства золы, определяют также способы ее удаления, транспортирования и использования.
Влажность топлива определяется количеством содержащейся в нем воды (Н2О).
Влагу топлива подразделяют на две части: внутреннюю и внешнюю.
К внутренней относится коллоидная и гидратная влага.
Коллоидная влага («клеевидная» от др. греч. κ оλ λ a – клей и ε iδ oς – вид) связана с органической частью топлива и распределяется очень равномерно в его массе. Количество коллоидной влаги зависит от химической природы и состава топлива, а также от содержания влаги в атмосферном воздухе.
Гидратная (кристаллизационная) влага химически связана с минеральными примесями. Содержание гидратной влаги в топливе незначительно. Больше всего ее количество заметно в многозольных топливах.
Часть коллоидной влаги при просушке испаряется, содержание гидратной влаги при этом остается постоянным, она может быть удалена только при высоких температурах.
Внешнюю влагу топлива составляют поверхностная и капиллярная влага, которая попадает в топливо из окружающей среды при его добыче, транспортировке и хранении.
Внешняя влага удаляется механическими методами и сушкой.
Гигроскопической влажностью называют влажность воздушно-сухого топлива при определенных условиях: температуре воздуха 20 ±1°С и его относительной влажности 65 ±5 % [16].
Твердое топливо при пребывании на воздухе может терять или поглощать влагу до тех пор, пока давление насыщенного пара влаги топлива не уравновесится с парциальным давлением влаги воздуха.
Воздушно-сухим называется твердое топливо с установившейся в естественных условиях влажностью.
Влажность рабочей массы различных топлив изменяется в широких пределах. Рабочим называется такой вид топлива, в котором оно непосредственно подается в топки и горелки.
Для определения влажности топлива используют стандартную методику (прил. 2).
При сжигании топлива влага испаряется в первую очередь, потребляя часть теплоты. В реальных условиях водяные пары выбрасываются вместе с продуктами сгорания, что приводит к снижению теплоты сгорания, увеличению расхода топлива, объема продуктов сгорания, а следовательно, к увеличению потерь теплоты с уходящими газами и затрат на удаление уходящих газов из КА.
Высокая влажность способствует выветриванию и самовозгоранию твердого топлива при его хранении.
При повышенной влажности ухудшается сыпучесть твердого топлива. В зимнее время может происходить смерзание топлива, что нарушает нормальную работу систем топливоподачи.
Выход летучих и кокса. При нагревании твердого топлива происходит распад сложных углеводородных соединений, составляющих горючую массу топлива. В результате этого выделяются горючие газы – водород (Н2), углеводороды (в основном метан СН4), окись углерода (СО), а также негорючие газы – углекислый газ (СО2) и водяные пары (Н2О). Этот процесс называется выходом летучих веществ. Состав и теплота сгорания летучих зависят от вида и марки топлива. По мере увеличения химического возраста топлива количество летучих уменьшается.
После отгонки летучих из топлива образуется коксовый остаток.
В зависимости от топлива, коксовый остаток может быть порошкообразным или спекшимся. Спекание кокса происходит в случае, если топливо содержит битуминозные вещества, которые при нагревании переходят в пластическое состояние.
Угли, образующие спекшийся коксовый остаток, являются ценным технологическим сырьем. В первую очередь для производства металлургического кокса.
Свойства коксового остатка зависят от состава органических соединений горючей массы топлива.
Для определения выхода летучих и кокса используют стандартную методику (прил. 3).
3. Состав топлива
Важнейшей характеристикой любого топлива является его химический состав. По известному химическому составу топлива могут быть выполнены все расчеты, связанные с его использованием: расчет необходимого объема воздуха для сжигания; расчет объема и состава дымовых газов и др.
Любое топливо состоит из горючей массы и балласта. При всем разнообразии различных видов топлива горючими элементами являются: углерод, водород, кислород и сера.
Отметим, что масса серы, участвующей в горении, состоит из серы органической S о, которая входит в состав органических соединений, и серы колчеданной S к, которая входит в состав железного колчедана FeS2 и других сернистых соединений, окисляемых кислородом, рис. 3.1 [11].
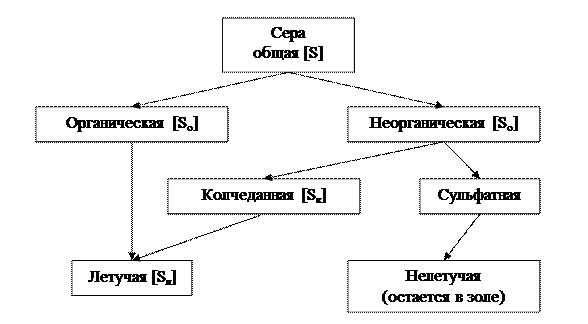
Рис. 3.1. Природа и свойства серы в топливе
Твердое и жидкое топливо состоит, как правило, из сложных веществ (органических соединений), определить содержание которых в топливе достаточно сложно. Поэтому применяется более простой способ, который позволяет характеризовать состав топлива массовыми % химических элементов, из которых оно состоит.
Горючими элементами топлива являются, %: углерод С, водород Н и сера Sл = Sо + Sк (индекс «л» означает «летучая сера», т. е. та сера в топливе, которая окисляется кислородом).
Кроме горючих элементов топливо содержит, %: негорючие органические элементы кислород О и азот N, входящие в состав топлива в виде сложных высокомолекулярных соединений; негорючие минеральные примеси, например, Al2O3, SiO2, CаO, Fe2O3, CaSO4 и др. составляющие, золу топлива А, которая остается после его сгорания; влагу топлива W, которая является балластной примесью, как и зола, снижающей качество топлива.
В качестве характеристик состава твердого топлива различают рабочую, аналитическую, сухую, горючую (сухую беззольную) и органическую массы, табл. 3.1 [1; 2; 14]. В жидком топливе – рабочую и сухую массы.
Таблица 3.1
Масса твердого топлива и состав
| Обозначающий индекс | Углерод С | Водород Н | Кислород О | Азот N | Сера органическая Sо | Сера колчеданная Sк | Балласт Б |
| Зола А | Влага W p | ||||||
| аналитическая W а | внешняя W вн | ||||||
| о | Органическая | ||||||
| г | Горючая (сухая беззольная) | ||||||
| с | Сухая | ||||||
| a | Аналитическая | ||||||
| р | Рабочая (рабочее топливо) |
Органическая масса состоит из углерода, водорода, кислорода, азота и серы, входящей в состав органических соединений. Это условное состояние топлива, не содержащего влаги и минеральной массы:
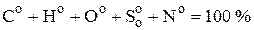 . (3.1)
. (3.1)
Горючая масса (сухая беззольная) близка по составу к органической массе. Отличается от нее наличием колчеданной, или пиритной серы, входящей в состав железного колчедана (FeS2) и других сернистых соединений, окисляемых кислородом в процессе горения топлива. Это условное состояние топлива, не содержащего влаги (кроме гидратной) и золы:
Cг + Hг + Oг + 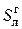 + Nг = 100%. (3.2)
+ Nг = 100%. (3.2)
Сухая масса состоит из горючих компонентов и минеральных веществ, образующих при сгорании топлива золу. В этом состоянии топливо не содержит влаги (кроме гидратной):
Cс + Hс + Oс + 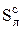 + Nс + Ас = 100%. (3.3)
+ Nс + Ас = 100%. (3.3)
Рабочая масса состоит из сухой массы и всей влаги топлива, именно этот состав топлива подается в топки и горелки:
Cр + Hр + Oр + 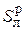 + Nр + Ар + Wр = 100%. (3.4)
+ Nр + Ар + Wр = 100%. (3.4)
Аналитическая масса – рабочая масса воздушно-сухого топлива. Соответствует аналитическому состоянию топлива, т. е. состоянию аналитической пробы топлива, влажность которого доведена до равновесного состояния с влажностью воздуха в лабораторном помещении [14]. Используется обычно для проведения химического анализа:
Cа + Hа + Oа + 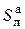 + Nа + Аа + Wа = 100%. (3.5)
+ Nа + Аа + Wа = 100%. (3.5)
Пересчет состава топлива с одной массы на другую производится по очевидным соотношениям с помощью множителей, приведенных в табл. 3.2 [6].
Таблица 3.2
Множители для перерасчета состава топлива с одной массы на другую
| Заданная масса топлива | Коэффициенты пересчета на массу | ||||
| рабочую | сухую | горючую | органическую | аналитическую | |
| рабочая | 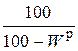
| 
| 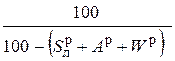
| 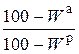
| |
| сухая | 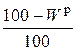
| 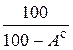
| 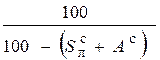
| 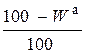
| |
| горючая | 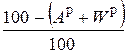
| 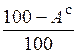
| 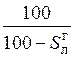
| 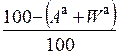
| |
| органическая | 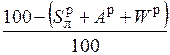
| 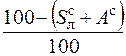
| 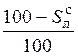
| 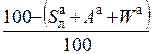
| |
| аналитическая | 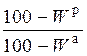
| 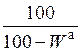
| 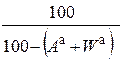
| 
|
Примечание к табл. 3.2:
1) пересчет рабочего состава одного топлива при изменении его влажности проводится по очевидным формулам, приведенным в прил. 4;
2) расчет рабочего состава топлива, состоящего из смеси двух твердых или жидких топлив, производится по формулам, приведенным в прил. 5;
3) пример расчетов по определению состава топлива приводится в прил. 6.
Химический состав газообразного топлива чаще всего задается объемными процентами входящих в газовую смесь компонентов.
По определению:
· объемный % i-го компонента – это объемная доля компонента ri, умноженная на 100;
· объемная доля – это отношение приведенного объема i -го компонента Vi к объему всей газовой смеси V см , из которой состоит топливо;
· приведенный объем i-го компонента газовой смеси Vi – это объем, который один этот компонент мог бы занимать при условии, что его давление и температура будут равны давлению и температуре всей газовой смеси.
В общем случае промышленное газообразное топливо может содержать следующие газы: окись углерода (СО); водород (Н2); метан (СН4); этан (С2Н6); пропан (С3Н8); бутан (С4Н10); пентан (С5Н12); этилен (С2Н4); пропилен (С3Н6); сероводород (Н2S); двуокись углерода (СО2); азот (N2); кислород (О2).
Если в газообразном топливе присутствует кислород, то при расчете горения его необходимо учитывать, т. е. воздуха на сжигание топлива в этом случае потребуется меньше.
Пример: природный газ Саратовского месторождения имеет состав [2]:
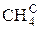
| 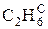
| 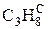
| 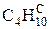
| 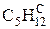
| 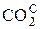
| 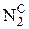
| Сумма, % |
| 94, 0 | 1, 2 | 0, 7 | 0, 4 | 0, 2 | 0, 2 | 3, 3 | 100, 0 |
Примечание:
Необходимо учитывать, что для газообразного топлива в справочной литературе дается состав сухого газа. Пересчет состава газообразного топлива с сухого на влажный производится следующим образом. Вначале определяется объемная доля Н2О в газе при нормальных условиях (условная величина, т. к. плотность паров Н2О при нормальных условиях 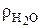 условно определяется формулой
условно определяется формулой
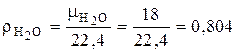 кг/нм3,
кг/нм3,
где 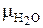 – молярная масса воды, кг / кмоль; 22, 4 м3 – объем, который занимает 1 кмоль любого идеального газа при нормальных условиях (следствие из закона Авогадро).
– молярная масса воды, кг / кмоль; 22, 4 м3 – объем, который занимает 1 кмоль любого идеального газа при нормальных условиях (следствие из закона Авогадро).
По определению объемной доли в газовой смеси:
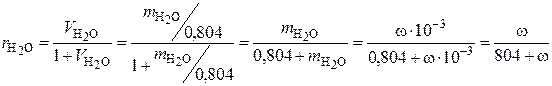 , (3.5)
, (3.5)
где 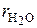 – объемная доля паров Н2О в газообразном топливе;
– объемная доля паров Н2О в газообразном топливе; 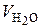 – приведенный объем паров в газообразном топливе, нм3;
– приведенный объем паров в газообразном топливе, нм3; 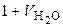 – объем газовой смеси рабочего (влажного) топлива, который соответствует 1 нм3 сухого топлива, нм3;
– объем газовой смеси рабочего (влажного) топлива, который соответствует 1 нм3 сухого топлива, нм3; 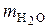 – масса Н2О в объеме рабочего (влажного) топлива, равном
– масса Н2О в объеме рабочего (влажного) топлива, равном  , кг; ω – содержание влаги в газообразном топливе, г / нм3 (сухого газа).
, кг; ω – содержание влаги в газообразном топливе, г / нм3 (сухого газа).
Содержание влаги в объемных процентах в рабочем топливе по определению составит:
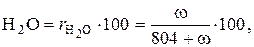 %. (3.6)
%. (3.6)
Влагосодержание газа при различных температурах приводится в прил. 7.
Зная по (3.6) процентное содержание влаги в рабочем топливе, можно рассчитать состав влажного рабочего газа по известному составу сухого газа:
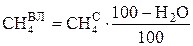 , %;
, %;
(3.7)
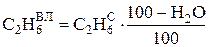 , %; и т. д.
, %; и т. д.
В природном газе содержится небольшое количество влаги, примерно 0, 5…1, 5 %, так как при транспортировании газа на большие расстояния он подвергается тщательной очистке от различных примесей и влаги.
При решении задач, в случае отсутствия данных по влаге, влажность газообразного топлива принимать Н2О = 1 %.
Пример расчета рабочего состава для природного газа приводится в прил. 8.
4. Теплота сгорания топлива
Горение – это интенсивная реакция окисления, в которой выделение химической энергии сопровождается тепловым излучением.
Сгорание топлива может быть полным и неполным.
При полном сгорании в продуктах горения образуются вещества, не способные к дальнейшему окислению: СО2, Н2О, SО2.
При неполном сгорании, в образовавшихся продуктах горения присутствуют вещества, способные к дальнейшему окислению: СО, Н2S и др.
Например, результат полного сгорания углерода в виде графита описывается стехиометрическим уравнением [3]:
С + О2 = СО2 + 34, 07 МДж / кг. (4.1)
При неполном сгорании:
С + 0, 5 · О2 = СО + 10, 27 МДж / кг. (4.2)
Примечание:
Содержащийся в твердом и жидком топливе углерод, так же, как и водород, входит в состав сложных органических соединений, образующих горючую массу топлива.
В технике различают высшую 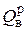 и низшую
и низшую 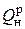 теплоты сгорания рабочего топлива (теплотворная способность топлива, или теплотворность).
теплоты сгорания рабочего топлива (теплотворная способность топлива, или теплотворность).
Высшая теплота сгорания топлива 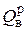 – это теплота, которая выделяется при полном сгорании всех горючих компонентов 1 кг или 1 нм3 топлива.
– это теплота, которая выделяется при полном сгорании всех горючих компонентов 1 кг или 1 нм3 топлива.
Примечание: 1 нм3 – это 1 м3 газа, находящийся при нормальных условиях (н.у.), т. е. при р н = 101325 Па и Тн = 273, 15 К.
Физический смысл 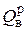 можно представить следующим образом. После полного сгорания 1 кг или 1 нм3 топлива образуется высокотемпературная газовая смесь (дымовые газы), состоящая из пяти газов: СО2, Н2О, SО2, N2 и О2. Эту смесь охлаждают до 0º С. Теплоту, которую потребуется отвести при таком охлаждении, называют высшей теплотой сгорания топлива
можно представить следующим образом. После полного сгорания 1 кг или 1 нм3 топлива образуется высокотемпературная газовая смесь (дымовые газы), состоящая из пяти газов: СО2, Н2О, SО2, N2 и О2. Эту смесь охлаждают до 0º С. Теплоту, которую потребуется отвести при таком охлаждении, называют высшей теплотой сгорания топлива 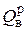 . Очевидно, что пары Н2О, находящиеся в дымовых газах, в конце процесса охлаждения (при 0º С) будут находиться в жидкой фазе, т. к. при 100º С произойдет их практически полная конденсация.
. Очевидно, что пары Н2О, находящиеся в дымовых газах, в конце процесса охлаждения (при 0º С) будут находиться в жидкой фазе, т. к. при 100º С произойдет их практически полная конденсация.
Значение 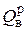 определяется экспериментально (прил. 9), либо рассчитывается по эмпирическим формулам по известному элементарному составу топлива.
определяется экспериментально (прил. 9), либо рассчитывается по эмпирическим формулам по известному элементарному составу топлива.
В тепловых агрегатах, как правило, отработанные дымовые газы находятся при давлении, близком к атмосферному, и имеют температуру несколько выше 100º С, а значит вода в них находится в виде пара. Это необходимо, чтобы исключить конденсацию пара в трубе, через которую дымовые газы выбрасываются в атмосферу (при конденсации труба быстро разрушается).
В связи с этим, для удобства проведения теплотехнических расчетов (чтобы не учитывать в них теплоту испарения Н2О), вводится низшая теплота сгорания топлива 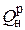 . Значение
. Значение 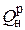 определяется по известной
определяется по известной 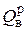 путем пересчета. Из
путем пересчета. Из 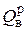 вычитается теплота, которая высвобождается при конденсации Н2О в дымовых газах при 100º С. А также то количество теплоты, на которое отличаются процессы охлаждения воды (от 100º С до 0º С) от охлаждения водяного пара (тоже от 100º С до 0º С). Это отличие можно рассчитать по известным значениям средних теплоемкостей воды и водяного пара при постоянном давлении (теплоемкость пара примерно в два раза меньше теплоемкости воды).
вычитается теплота, которая высвобождается при конденсации Н2О в дымовых газах при 100º С. А также то количество теплоты, на которое отличаются процессы охлаждения воды (от 100º С до 0º С) от охлаждения водяного пара (тоже от 100º С до 0º С). Это отличие можно рассчитать по известным значениям средних теплоемкостей воды и водяного пара при постоянном давлении (теплоемкость пара примерно в два раза меньше теплоемкости воды).
Указанная выше разница между 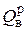 и
и 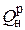 составляет приблизительно 2510 кДж (600 ккал) на 1 кг влаги [3].
составляет приблизительно 2510 кДж (600 ккал) на 1 кг влаги [3].
Таким образом, для твердого и жидкого топлива можно записать:
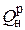 =
= 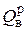 – 2510 ·
– 2510 · 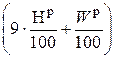 , кДж / кг, (4.3)
, кДж / кг, (4.3)
где  и
и 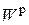 – содержание водорода и влаги в рабочем топливе, %.
– содержание водорода и влаги в рабочем топливе, %.
Коэффициент 9 перед 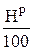 в формуле (4.3) указывает на то, что из 1 кг Н2 при окислении образуется 9 кг Н2О.
в формуле (4.3) указывает на то, что из 1 кг Н2 при окислении образуется 9 кг Н2О.
На практике для расчета низшей теплоты сгорания твердого или жидкого рабочего топлива по известному элементарному составу пользуются эмпирической формулой Д. И. Менделеева [10]:
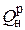 = 338Cр + 1025Hр – 108, 5 (Oр –
= 338Cр + 1025Hр – 108, 5 (Oр –  ) – 25 W р, кДж / кг. (4.4)
) – 25 W р, кДж / кг. (4.4)
Низшую теплоту сгорания газообразного топлива по компонентному составу вычисляют по формуле [10]:
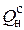 = 108 Н2 + 126 СО + 234 Н2S + 358 СН4 + 591 С2Н4 +
= 108 Н2 + 126 СО + 234 Н2S + 358 СН4 + 591 С2Н4 +
+ 638 С2Н6 + 860 С3Н6 + 913 С3Н8 + 1135 С4Н8 + 1187 С4Н10 +
+ 1461 С5Н12 + 1403 С6Н6, кДж / кг, (4.5)
где Н2, СО, Н2S, СН4, С2Н4, С2Н6, С3Н6, С3Н8, С4Н8, С4Н10, С5Н12, С6Н6 – объемные % соответствующих компонентов топлива, а коэффициенты перед ними – тепловые эффекты реакций окисления данного горючего компонента, кДж / нм3, деленные на 100.
Помимо 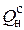 иногда в расчетах используется
иногда в расчетах используется 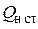 – теплота сгорания при стандартных условиях (20º С, 760 мм рт. ст.):
– теплота сгорания при стандартных условиях (20º С, 760 мм рт. ст.):
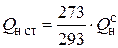 . (4.6)
. (4.6)
5. Условное топливо
Эффективность использования топлива в тепловом агрегате характеризуется удельным расходом топлива – это затраты топлива на единицу продукции.
Например, на получение в котельном агрегате 1 т пара расходуется 50 нм3 природного газа, т. е. удельный расход 50 нм3 / т. Для удобства сопоставления различных видов топлива, например, при сравнении удельных расходов, вводится понятие – условное топливо (у.т). При этом принято, что низшая рабочая теплота сгорания условного топлива 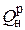 составляет 29300 кДж / кг у.т. (7000 ккал / кг у.т).
составляет 29300 кДж / кг у.т. (7000 ккал / кг у.т).
Затраты или объем реального топлива всегда можно пересчитать в затраты (объем) условного топлива.
Например: пусть в тепловом агрегате расходуется в единицу времени В кг / с, твердого топлива с низшей рабочей теплотой сгорания 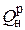 , кДж / кг. Соответственно в этом тепловом агрегате в единицу времени расходуется теплота:
, кДж / кг. Соответственно в этом тепловом агрегате в единицу времени расходуется теплота:
Q тех = В · 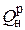 , (5.1)
, (5.1)
где Q тех – теплота на осуществление технологического процесса, кДж / с.
Величина Q тех при любом виде топлива должна оставаться неизменной, в частности, и при использовании условного топлива:
Q тех = В · 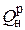 = В у.т · 29300, (5.2)
= В у.т · 29300, (5.2)
где В у.т – расход условного топлива в рассматриваемом тепловом агрегате, кг у.т./ с или т у.т./ с.
Из (5.2) получаем:
В у.т = В · Э, кг у.т. / с или т у.т./с, (5.3)
где 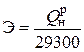 – безразмерная величина, которая называется тепловой эквивалент топлива.
– безразмерная величина, которая называется тепловой эквивалент топлива.
6. Расчет горения топлива
6.1. Общие сведения
Для сжигания топлива в топках и горелках используется, как правило, атмосферный воздух.
Состав сухого атмосферного воздуха приведен в табл. 6.1.
Также в атмосферном воздухе содержится некоторое количество водяного пара, которое определяет его влажность. Количество водяного пара в атмосферном воздухе колеблется от 0, 1 до 2, 8 об. % в зависимости от сезона, климата и погоды.
Таблица 6.1
Состав сухого атмосферного воздуха в нижних слоях атмосферы
| Газы атмосферы | Содержание, об. % | Газы атмосферы | Содержание, об. % |
| Азот, N2 | 78, 09 | Криптон, Kr | 10–4 |
| Кислород, O2 | 20, 95 | Водород, H2 | 5 · 10–5 |
| Аргон, Ar | 0, 93 | Полуоксид, N2O | 5 · 10–5 |
| Углекислота, CO2 | 0, 03 | Ксенон, Xe | 8 · 10–6 |
| Неон, Ne | 8 · 10–3 | Озон, O3 | 10–6 |
| Гелий, He | 5, 24 · 10–3 | Рений, Rn | 6 · 10–18 |
Во многих теплотехнических расчетах наличием в воздухе Ar, CO2 и т. д. можно пренебречь без существенного снижения точности результата. То есть принимается, что сухой воздух состоит из двух компонентов – азота (N2) и кислорода (O2):
N2 = 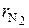 ∙ 100 = 79 %, (6.1)
∙ 100 = 79 %, (6.1)
O2 = 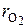 ∙ 100 = 21 %, (6.2)
∙ 100 = 21 %, (6.2)
где 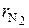 и
и 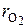 – объемные доли азота и кислорода (безразмерные величины); N2 и O2 – объемные проценты азота и кислорода в сухом воздухе, %.
– объемные доли азота и кислорода (безразмерные величины); N2 и O2 – объемные проценты азота и кислорода в сухом воздухе, %.
Влажность воздуха принимается постоянной и равной 10 г Н2О на 1 кг воздуха [5].
Из (6.1) и (6.2) следует, что в сухом воздухе на один объем О2 приходится: 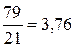 объемов N2;
объемов N2; 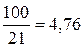 объемов самого воздуха.
объемов самого воздуха.
Теоретически необходимый объем воздуха – это минимальный объем воздуха, который потребуется для полного сгорания 1 кг или 1 нм3 топлива.
На практике, для достижения полного сгорания топлива воздуха подают больше, чем теоретически необходимо. Это происходит из-за того, что идеально перемешать горючее и окислитель в реальных топках и горелках невозможно. В соответствии с этим фактом вводится важная техническая характеристика горения – коэффициент избытка воздуха α:
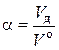 , (6.3)
, (6.3)
где V o – теоретически необходимый объем воздуха, нм3 /кг (нм3 /нм3); V д – действительный объем воздуха, нм3 / кг (нм3 / нм3).
Значение V o определяется из стехиометрических уравнений химических реакций окисления горючих элементов топлива. Значение V д определяется в результате экспериментальной отработки режимов для конкретных топок и горелок.
6.2. Расчет объема воздуха при горении
твердого и жидкого топлива
Элементарный рабочий состав твердого и жидкого топлива, как было показано выше, задается массовыми, %. Например, высокосернистый мазут имеет следующий состав [13]:
| Ср | Нр | 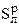
| Nр | Ор | Ар | W р | Сумма, % |
| 83, 0 | 10, 4 | 2, 8 | 0, 7 | – | 0, 1 | 3, 0 | 100, 0 |
Горючими элементами в топливе являются: углерод, водород, сера.
Рассмотрим стехиометрические реакции полного окисления этих элементов:
С + О2 = СО2; (6.4)
S + О2 = SО2; (6.5)
Н2 + 0, 5О2 = Н2О. (6.6)
Из (6.4) следует, что для окисления 1 кмоля С требуется 1 кмоль О2.
1 кмоль С + 1 кмоль О2 = 1 кмоль СО2 + 407 кДж.
С учетом средней молярной массы получаем выражение:
12 кг С + 32 кг О2 = 44 кг СО2 + 407 кДж.
Тогда для окисления 1 кг С потребуется кислорода:
1 кг С + 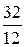 кг О2 =
кг О2 = 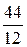 кг СО2 +
кг СО2 + 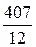 кДж / кг
кДж / кг
или
1 кг С + 2, 67 кг О2 = 3, 67 кг СО2 + 33, 9 кДж / кг.
Объем 1 кмоля любого идеального газа при нормальных условиях, в соответствии со следствием из закона Авогадро, равен 22, 4 нм3. Таким образом, для полного окисления 12 кг С потребуется 22, 4 нм3 О2. Одному объему кислорода в воздухе соответствует 4, 76 объема самого воздуха. Значит, для полного сжигания 12 кг углерода потребуется 4, 76 · 22, 4 нм3 воздуха. Соответственно теоретический объем воздуха в случае горения углерода будет равен:
V o = 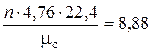 , нм3 / кг углерода, (6.7)
, нм3 / кг углерода, (6.7)
где n – коэффициент, стоящий перед О2 в стехиометрическом уравнении (6.4), кмоль; μ с – молярная масса углерода, μ с = 12 кг / кмоль.
Аналогичным образом из (6.5) для случая горения серы можно получить:
V o = 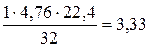 , нм3 / кг серы. (6.8)
, нм3 / кг серы. (6.8)
Из (6.6) следует, что для окисления 1 кмоля водорода, который весит 2 кг, потребуется 0, 5 кмолей кислорода, что будет составлять 0, 5 · 22, 4 · 4, 76 нм3 воздуха. Соответственно для этого случая:
V o = 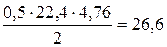 , нм3 / кг водорода. (6.9)
, нм3 / кг водорода. (6.9)
Обобщенная формула для расчета теоретически необходимого объема воздуха имеет вид:
V o =  , нм3 / кг, (6.10)
, нм3 / кг, (6.10)
где n – коэффициент, стоящий перед О2 в стехиометрическом уравнении реакции окисления соответствующего вещества, кмоль; μ – молярная масса окисляемого вещества, кг / кмоль.
Для полного сгорания всех горючих элементов 1 кг твердого или жидкого топлива, в соответствии с (6.7) – (6.9), могло бы потребоваться следующее количество воздуха V′ o, без учета ОР:
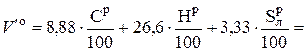
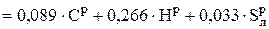 , нм3 / кг. (6.11)
, нм3 / кг. (6.11)
В топливе в высокомолекулярных соединениях содержится кислород Ор, который по существу также участвует в окислении горючих элементов. Из-за этого реально воздуха потребуется меньше, чем рассчитывается по (6.11). Следовательно, из  необходимо вычесть эквивалентный Ор объем воздуха V э, который рассчитывается следующим образом.
необходимо вычесть эквивалентный Ор объем воздуха V э, который рассчитывается следующим образом.
Сначала определим массу О2 в 1 кг топлива 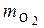 :
:
 , кг кислорода / кг топлива.
, кг кислорода / кг топлива.
Зная массу, определяем число кмолей О2 в 1 кг топлива 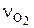 :
:
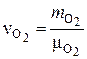 , кмоль,
, кмоль,
где 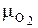 – молярная масса кислорода,
– молярная масса кислорода, 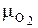 = 32 кг / кмоль.
= 32 кг / кмоль.
По числу кмолей определяем нормальный объем кислорода в 1 кг топлива 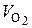 :
:
 , нм3 кислорода / кг топлива. (6.12)
, нм3 кислорода / кг топлива. (6.12)
Из (6.12) эквивалентный объем воздуха рассчитывается исходя из содержания в воздухе 21 % кислорода по объему:
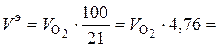
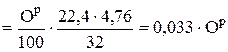 нм3 воздуха/ кг топлива. (6.13)
нм3 воздуха/ кг топлива. (6.13)
Окончательно теоретически необходимый объем воздуха V o, который требуется для полного сгорания 1 кг твердого или жидкого топлива, определяется путем вычитания (6.13) из (6.11):
V o =  – V э = 0, 089Ср + 0, 266Нр + 0, 033 (
– V э = 0, 089Ср + 0, 266Нр + 0, 033 (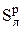 – Ор), нм3 / кг. (6.14)
– Ор), нм3 / кг. (6.14)
Примечание:
Часть твердого топлива в топках теряется: со шлаками; за счет просыпи через колосниковую решетку; уносится в виде пыли газовым потоком. Эти потери называются механическими. При учете механических потерь их оценивают как потери углерода:
Смех = Сш + Спр + Су , %, (6.15)
где Смех – механические потери углерода; Сш, Спр, Су – потери углерода со шлаком, с просыпью и уносимые газовым потоком соответственно.
Значение Смех обычно составляет 3…5 %. Соответственно при расчете теоретически необходимого объема воздуха для сгорания твердого топлива вместо Ср используется фактический углерод 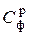 :
:
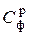 = Ср – Смех = (0, 95…0, 97) · Ср, %. (6.16)
= Ср – Смех = (0, 95…0, 97) · Ср, %. (6.16)
6.3. Расчет объема воздуха при горении
газообразного топлива
Химический состав газообразного топлива, как было показано выше, задается объемными % входящих в топливо (газовую смесь) компонентов. В общем случае сухое (без учета паров Н2О) техническое газообразное топливо может иметь состав:
| СО | Н2 | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н15 | С2Н4 | С3Н6 | Н2S | СО2 | N2 | О2 | Сумма, % |
| … | … | … | … | … | … | … | … | … | … | … | … | … | 100, 0 |
Объем кислорода, необходимого для полного сгорания 1 нм3 газообразного топлива, подсчитывается на базе стехиометрических уравнений окисления (горения) отдельных горючих компонентов, входящих в его состав:
окись углерода: СО + 0, 5 · О2 = СО2 ; (6.17)
водород: Н2 + 0, 5 · О2 = Н2О; (6.18)
метан: СН4 + 2 · О2 = СО2 + 2 · Н2О; (6.19)
этан: С2Н6 + 3, 5 · О2 = 2 · СО2 + 3 · Н2О; (6.20)
пропан: С3Н8 + 5 · О2 = 3 · СО2 + 4 · Н2О; (6.21)
бутан: С4Н10 + 6, 5 · О2 = 4 · СО2 + 5 · Н2О; (6.22)
пентан: С5Н12 + 8 · О2 = 5 · СО2 + 6 · Н2О; (6.23)
этилен: С2Н4 + 3 · О2 = 2 · СО2 + 2 · Н2О; (6.24)
пропилен: С3Н6 + 4, 5 · О2 = 3 · СО2 + 3 · Н2О; (6.25)
сероводород: Н2S + 1, 5 · О2 = SО2 + Н2О. (6.26)
Например, из (6.20) следует, что для полного сгорания 1 нм3 этана (С2Н6) потребуется 3, 5 нм3 О2 (так как на сгорание 1 кмоля С2Н6 требуется 3, 5 кмоля кислорода (О2), а 1 кмоль любого идеального газа при нормальных условиях, по следствию из закона Авогадро, занимает объем 22, 4 м3). Соответственно для сгорания 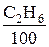 нм3 этана, содержащегося в 1 нм3 топлива, потребуется 3, 5 ·
нм3 этана, содержащегося в 1 нм3 топлива, потребуется 3, 5 · 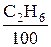 нм3 кислорода.
нм3 кислорода.
Таким образом, по уравнениям (6.17) – (6.26) можно подсчитать объем теоретически необходимого кислорода для сгорания 1 нм3 топлива 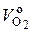 :
:
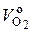 = 0, 01 (0, 5 · СО + 0, 5 · Н2 + 2 · СН4 + 3, 5 · С2Н6 + 5 · С3Н8 +
= 0, 01 (0, 5 · СО + 0, 5 · Н2 + 2 · СН4 + 3, 5 · С2Н6 + 5 · С3Н8 +
+ 6, 5 · С4Н10 + 8 · С5Н12 + 3 · С2Н4 + 4, 5 · С3Н6 +
+ 1, 5 · Н2S – О2), нм3 / нм3. (6.27)
Если для компактности записи все углеводороды, входящие в топливо, обозначить общей условной формулой C m H n (m – количество атомов углерода, n – количество атомов водорода в компоненте), то вместо (6.27) можно записать:
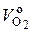 = 0, 01 (0, 5 · СО + 0, 5 · Н2 + 1, 5 · Н2S +
= 0, 01 (0, 5 · СО + 0, 5 · Н2 + 1, 5 · Н2S +
+ ∑ (m + 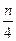 ) C m H n – О2), нм3 / нм3, (6.28)
) C m H n – О2), нм3 / нм3, (6.28)
где условный знак ∑ означает суммирование по всем входящим в топливо углеводородам [см. формулу (6.27)].
Соответственно теоретически необходимый объем воздуха рассчитывается по (6.28), исходя из содержания в воздухе 21 % кислорода по объему:
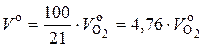 , (6.29)
, (6.29)
или с учетом (6.28):
V o = 0, 0476 · [0, 5 (СО + Н2) + 1, 5 Н2S + 2 СН4 +
+ 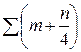 · С m H n – O2], нм3 / нм3. (6.30)
· С m H n – O2], нм3 / нм3. (6.30)
6.4. Расчет объема дымовых газов при горении топлива
6.4.1. Общие сведения
При полном сгорании любых органических топлив образуются следующие газообразные продукты сгорания: СО2, SО2 и Н2О.
Если происходит неполное сгорание, то считается, что к трем названным продуктам добавляется окись углерода СО – токсичный газ, а также могут добавляться и другие газы.
В общем случае объем продуктов сгорания 1 кг или 1 нм3 топлива V гскладывается из объема сухих газов V сги объема водяного пара  :
:
V г= V сг +  , нм3 / кг; нм3 / нм3. (6.31)
, нм3 / кг; нм3 / нм3. (6.31)
При этом:
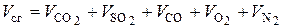 , (6.32)
, (6.32)
где 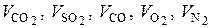 – приведенные объемы соответствующих компонентов в сухой газовой смеси, образовавшейся при сгорании 1 кг или 1 нм3 топлива, нм3 / кг или нм3 / нм3 топлива.
– приведенные объемы соответствующих компонентов в сухой газовой смеси, образовавшейся при сгорании 1 кг или 1 нм3 топлива, нм3 / кг или нм3 / нм3 топлива.
Химический состав сухих дымовых газов определяется объемными %:
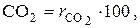 SО2 =
SО2 =  СО =
СО = 
О2 = 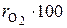 , N 2 =
, N 2 =  , (6.33)
, (6.33)
где 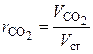 ,
, 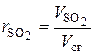 ,
, 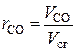 ,
, 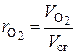 ,
,  – объемные доли соответствующих компонентов в сухой газовой смеси; СО2 , SО2 , СО, О2 , N2 – объемные проценты соответствующих компонентов в сухой газовой смеси, %.
– объемные доли соответствующих компонентов в сухой газовой смеси; СО2 , SО2 , СО, О2 , N2 – объемные проценты соответствующих компонентов в сухой газовой смеси, %.
При этом:
СО2 + SО2 + СО + О2 + N2 = 100 %. (6.34)
При расчетах для удобства вводится обозначение:
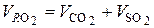 , (6.35)
, (6.35)
где 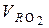 – объем трехатомных газов, %.
– объем трехатомных газов, %.
Соответственно подставляя (6.35) в (6.32):
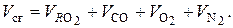 (6.36)
(6.36)
6.4.2. Расчет объема дымовых газов при полном горении
твердого и жидкого топлива
Состав такого топлива задается массовыми %:
Cр + Hр + Oр + 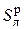 + Nр + Ар + W р = 100 %. (6.37)
+ Nр + Ар + W р = 100 %. (6.37)
При полном сгорании 1 кг топлива объем дымовых газов V гопределяется суммой:
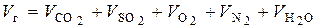 , нм3 / кг. (6.38)
, нм3 / кг. (6.38)
Расчет значений слагаемых, входящих в правую часть (6.38), производится следующим образом.
Для расчета 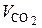 рассмотрим стехиометрическую реакцию окисления углерода:
рассмотрим стехиометрическую реакцию окисления углерода:
С + О2 = СО2. (6.39)
Из (6.39) следует, что из 1 кг углерода образуется СО2 в количестве 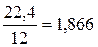 нм3/ кг. В 1 кг топлива содержится
нм3/ кг. В 1 кг топлива содержится 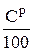 , кг углерода. Соответственно:
, кг углерода. Соответственно:
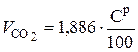 , нм3 / кг. (6.40)
, нм3 / кг. (6.40)
Аналогичным образом 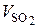 рассчитывается по реакции:
рассчитывается по реакции:
S + О2 = SО2 ; (6.41)
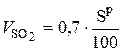 , нм3 / кг. (6.42)
, нм3 / кг. (6.42)
Итого для 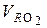 :
:
 = 1, 886 ·
= 1, 886 · 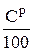 + 0, 7 ·
+ 0, 7 · 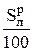 =
=
= 1, 886 · 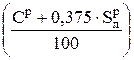 , нм3 / кг, (6.43)
, нм3 / кг, (6.43)
где 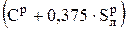 = КР называется приведенным углеродом, %.
= КР называется приведенным углеродом, %.
В общем случае при избытке воздуха (α > 1) часть воздуха не принимает участия в горении. Эта часть называется избыточным воздухом:
 (6.44)
(6.44)
где 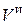 – объем избыточного воздуха, подаваемого при сжигании 1 кг топлива, нм3 / кг;
– объем избыточного воздуха, подаваемого при сжигании 1 кг топлива, нм3 / кг;  – действительный объем воздуха, подаваемый на сжигание 1 кг топлива, нм3 / кг;
– действительный объем воздуха, подаваемый на сжигание 1 кг топлива, нм3 / кг; 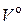 – объем теоретически необходимого воздуха для сжигания 1 кг топлива, нм3 / кг; α – коэффициент избытка воздуха.
– объем теоретически необходимого воздуха для сжигания 1 кг топлива, нм3 / кг; α – коэффициент избытка воздуха.
Так как в воздухе содержится 21 % О2 , для определения 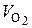 можно использовать (6.44):
можно использовать (6.44):
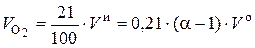 , нм3 / кг. (6.45)
, нм3 / кг. (6.45)
При расчете 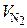 учитывается, что азот является инертным газом и не участвует в химических реакциях при горении топлива. То есть весь азот, который поступает в топку (горелку) вместе с действительным воздухом, и азот, который выделяется из топлива, проходя через топку (горелку) транзитом:
учитывается, что азот является инертным газом и не участвует в химических реакциях при горении топлива. То есть весь азот, который поступает в топку (горелку) вместе с действительным воздухом, и азот, который выделяется из топлива, проходя через топку (горелку) транзитом:
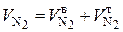 , (6.46)
, (6.46)
где 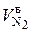 – приведенный объем N2 в действительном воздухе, подающимся при сгорании 1 кг топлива, нм3 / кг;
– приведенный объем N2 в действительном воздухе, подающимся при сгорании 1 кг топлива, нм3 / кг; 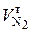 – объем N2, который выделяется при сгорании 1 кг топлива, нм3 / кг.
– объем N2, который выделяется при сгорании 1 кг топлива, нм3 / кг.
Так как в воздухе содержится 79 % N2, значение 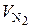 определяется:
определяется:
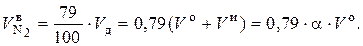 (6.47)
(6.47)
Значение 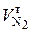 по определению рассчитывается путем деления соответствующей массы на плотность. В 1 кг топлива содержится
по определению рассчитывается путем деления соответствующей массы на плотность. В 1 кг топлива содержится 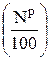 кг азота. Плотность азота
кг азота. Плотность азота 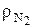 при нормальных условиях можно рассчитать по известной формуле:
при нормальных условиях можно рассчитать по известной формуле:
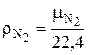 , кг / нм3, (6.48)
, кг / нм3, (6.48)
где  – молярная масса азота,
– молярная масса азота,  = 28 кг / кмоль; 22, 4 – объем, который занимает 1 кмоль любого идеального газа при нормальных условиях (следствие из закона Авогадро), нм3 / кмоль.
= 28 кг / кмоль; 22, 4 – объем, который занимает 1 кмоль любого идеального газа при нормальных условиях (следствие из закона Авогадро), нм3 / кмоль.
Соответственно для 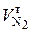 :
:
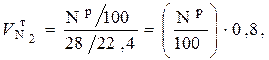 нм3 / кг. (6.49)
нм3 / кг. (6.49)
Подставляя (6.47) и (6.49) в (6.46), получаем:
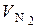 = 0, 79 · α ·
= 0, 79 · α · 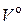 +
+ 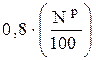 , нм3 / кг. (6.50)
, нм3 / кг. (6.50)
Вводя для объема двухатомных газов, входящих в (6.38), обозначение 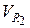 , можно записать очевидное равенство (которое также можно получить путем простейших арифметических преобразований):
, можно записать очевидное равенство (которое также можно получить путем простейших арифметических преобразований):
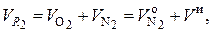 (6.51)
(6.51)
где  – приведенный объем азота в дымовых газах, при сгорании 1 кг топлива при условии, что коэффициент избытка воздуха α = 1, нм3 / кг.
– приведенный объем азота в дымовых газах, при сгорании 1 кг топлива при условии, что коэффициент избытка воздуха α = 1, нм3 / кг.
Равенство (6.51) отражает тот очевидный факт, что приведенный объем О2 и часть от приведенного объема N2, относящаяся к избыточному воздуху, вместе как раз и составляют объем этого избыточного воздуха V и.
Значение 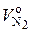 можно рассчитать по (6.50), приняв значение α = 1:
можно рассчитать по (6.50), приняв значение α = 1:
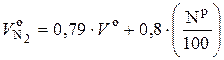 , нм3 / кг. (6.52)
, нм3 / кг. (6.52)
Примечание:
Для удобства проведения практических расчетов формулы (6.50) и (6.51) преобразуют следующим образом:
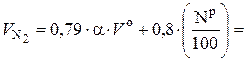
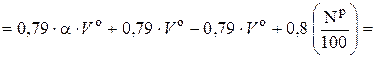
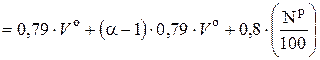 , (6.53)
, (6.53)
где 0, 79 · V о – приведенный объем N2 в теоретическом воздухе, нм3 / кг; 0, 79 · (α – 1) · V о – приведенный объем N2 в избыточном воздухе, нм3 / кг.
Подставив в (6.53) формулу (6.52), получим:
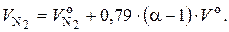 (6.54)
(6.54)
Подставляем в (6.51) формулы (6.45) и (6.54):
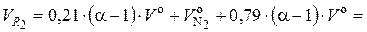
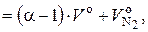 (6.55)
(6.55)
где (α – 1) · V о – объем избыточного воздуха, нм3 / кг.
При расчете 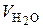 учитывается, что водяные пары в дымовых газах образуются по трем причинам:
учитывается, что водяные пары в дымовых газах образуются по трем причинам:
1) в результате испарения влаги, содержащейся в топливе 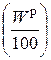 , кг (влаги) / кг (топлива);
, кг (влаги) / кг (топлива);
2) в результате окисления водорода 9 ·  , кг (влаги) / кг (топлива), где коэффициент 9, [кг (влаги) / кг (водорода)], это масса Н2О, которая образуется при окислении 1 кг Н2 в соответствии со стехиометрической реакцией Н2 + 0, 5 · О2 = Н2О;
, кг (влаги) / кг (топлива), где коэффициент 9, [кг (влаги) / кг (водорода)], это масса Н2О, которая образуется при окислении 1 кг Н2 в соответствии со стехиометрической реакцией Н2 + 0, 5 · О2 = Н2О;
3) в результате того, что атмосферный воздух, подающийся на горение, содержит некоторое количество паров воды (обычно в расчетах приближенно принимается, что в 1 кг атмосферного воздуха содержится 10 г Н2О) [5].
Таким образом, масса паров Н2О в дымовых газах 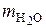 при сгорании 1 кг топлива равна:
при сгорании 1 кг топлива равна:
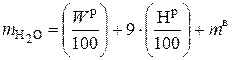 , кг / кг, (6.56)
, кг / кг, (6.56)
где m в – масса влаги, вносимая атмосферным воздухом, при сжигании 1 кг то
|
|