
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обработка результатов эксперимента
|
|
Изучение коагуляции гидрозоля железа
Цель работы: синтез гидрозоля гидроксида железа конденсационным методом, определение порога электролитной коагуляции золя и изучение зависимости его от заряда коагулирующего иона.
Сущность работы. Гидрозоль гидроксида железа синтезируют методом конденсации, путем проведения реакции гидролиза хлорида железа при 100°С: FeCl3 + 3H2O = Fe(OH)3 + 3HCl. Агрегативная устойчивость золя гидроксида железа обеспечивается наличием на поверхности дисперсных частиц двойных электрических слоев. Формулу мицеллы ионостабилизированного золя гидроксида железа можно записать следующим образом: {[Fe(OH)3]n·mFe3+·3(m – x)Cl− }3xCl−
В процессе коагуляции высокодисперсного золя гидроксида железа образуются сравнительно небольшие по размерам седиментационно устойчивые агрегаты, поэтому исследования коагуляции частиц [Fe(OH)3]n удобнее проводить с помощью турбидиметрического метода. Применимость этого метода основывается на сильной зависимости интенсивности ослабления светового потока от размеров частиц. При коагуляции частиц ослабление света увеличивается, следовательно, растет кажущаяся оптическая плотность.
Оборудование и реактивы. Фотоэлектроколориметр; кюветы стеклянные толщиной 1 см – 2 шт.; салфетки; электрическая плитка или колбонагреватель; круглая колба объемом 250 мл – 1 шт.; колба коническая объемом 100 мл – 10 шт.; градуированная пипетка объемом 10 мл – 1 шт.; градуированная пипетка объемом 5 мл – 2 шт.; мерная пипетка объемом 10 мл – 1 шт.; хлорид железа (III) – раствор, концентрацией 2 %; сульфат натрия – раствор, концентрацией 0, 0125 М; ацетат натрия – раствор концентрацией 0, 5М.
Выполнение работы
1. В колбу с 250 мл кипящей воды мерной пипеткой прилить 10 мл раствора хлорида железа. Образовавшийся золь, красно-коричневого цвета, охладить до комнатной температуры.
2. В 10 нумерованных колб емкостью 100 мл налить по 10 мл золя, дистиллированную воду и раствор электролита (Na2SO4 или CH3COONa) в следующих объемах:
| № | ||||||||||
| Объем воды, мл | 10, 0 | 9, 0 | 8, 5 | 8, 0 | 7, 5 | 7, 0 | 6, 5 | 6, 0 | 5, 5 | 5, 0 |
| Объем электролита, мл (Na2SO4 или CH3COONa) | 1, 0 | 1, 5 | 2, 0 | 2, 5 | 3, 0 | 3, 5 | 4, 0 | 4, 5 | 5, 0 |
3. Выдержать пробы 2-4 минуты.
4. Измерить оптическую плотность золя каждой колбы с помощью КФК-3 на длине волны 365 нм. Раствор сравнения – дистиллированная вода. При измерении оптической плотности действовать в соответствии с инструкцией к прибору.
Содержание протокола лабораторной работы
Наименование электролита и его химическая формула
Концентрация раствора электролита
Зависимость кажущейся оптической плотности золя гидроксида железа от объема добавленного электролита
| № колбы | Объем электролита V Э, мл | Объем воды V (H2O), мл | Оптическая плотность золя, D |
| 1, 0 | 9, 0 | ||
| 1, 5 | 8, 5 | ||
| 2, 0 | 8, 0 | ||
| 2, 5 | 7, 5 | ||
| 3, 0 | 7, 0 | ||
| 3, 5 | 6, 5 | ||
| 4, 0 | 6, 0 | ||
| 4, 5 | 5, 5 | ||
| 5, 0 | 5, 0 |
Обработка результатов эксперимента
1. Посторить график зависимости D = f (V эл) для Na2SO4 или CH3COONa.
2. По графику найти пороговые объемы электролита V эл, вызывающие быструю коагуляцию золя.
3. Рассчитать значение С кр, называемую порогом коагуляции
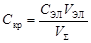 ,
,
где С ЭЛ – концентрация раствора электролита, применяемого для коагуляции, V ЭЛ – наименьший объем раствора электролита, V S – суммарный объем коллоидного раствора с электролитом.

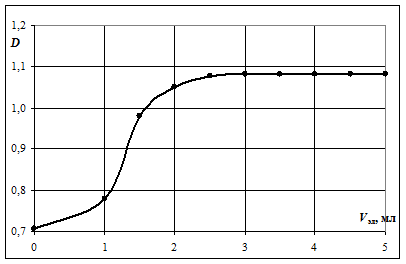
Рис. ___. Обработка графической зависимости D = f (V эл)
4. Сравнить найденные значения С кр для Na2SO4 и CH3COONa и проверить их соответствие правилу Шульце – Гарди.
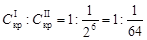 .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
|
|