
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекула водорода
|
|
Проблема активации этой молекулы важна т.к. водород один из основных реагентов НХС и ООС (гидрообработка, гидрогенолиз, гидрирование ненасыщенных соединений, синтезы из синтез-газа).
Молекула Н2 – слабый донор (IH2= 15, 4 эВ) и слабый акцептор (FH2= -0, 7 эВ).
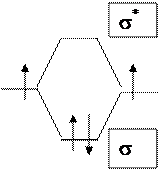
Рассмотрим возможности активации этой молекулы с точки зрения теории МО. Энергия диссоциации связи Н-Н зависит от заселенности орбиталей электронами (табл. 4).
Таблица 4
Энергия диссоциации связи Н-Н в зависимости от заселенности орбиталей
| Частица | ЕD, кДж/моль | LH-H, Å |
| Н2 | 430, 5 | 0, 74 |
| Н2+ | 259, 2 | 1, 07 |
| Н2 - | 17, 14 | 0, 86 |
 | |||||||||
 |
| ||||||||
 | |||||||||
 | |||||||||
Из приведенной таблицы и диаграммы МО следует, что есть два пути активации водорода: а) уменьшение заселенности связывающей орбитали, б) увеличение заселенности разрыхляющей орбитали.
Хотя сродство Н2 к Н+ довольно велико (в газовой фазе DНО = -322кДж/моль) активация протоном молекулы Н2 (вариант а) оказалась возможной только в растворе суперкислоты SbF5- HF в апротонных средах (SO2, SO2ClF), cудя по реакциям дейтерообмена и орто-пара конверсии. Вариант б оказался более простым. Активация водорода легко осуществляется основаниями (ОН-, КNH2, К). Промотирование электронов на разрыхляющую орбиталь водорода является решающим фактором активации (К+Н2-).
Первичные комплексы для водорода были получены примерно в 1980 г. Первым из них был (CO)3W(P i-Pr3)2(h2-H2), структура которого представляет собой октаэдр с молекулой водорода, занимающей одно координационное место в экваториальной плоскости вместе с тремя карбонилами. Длина связи Н-Н составляет 0, 84 Å (сравните с данными табл. 4). В аналогичном комплексе иридия Ir(H)2(h2-H2)(P(C6H11)3)2 наблюдается быстрый обмен между координированным молекулярным водородом и гидридными лигандами.
В большинстве случаев первичные η 2-комплексы не удаётся зафиксировать, и активация Н2 приводит к разрыву связи в молекуле водорода. Два основных направления превращения водорода при взаимодействии с комплексами переходных металлов.
1. В случае комплексов металлов в высоких степенях окисления с преобладанием акцепторных свойств происходит гетеролитический разрыв связи в водороде (электрофильное замещение Н+ в Н2 ионом или комплексом металла).
Cu2+ + H2 ® CuH+ + H+
PtCl2 + H2 ® ClPtH + HCl
RuCl63- + H2 ® H RuCl53- + HCl
2. Комплексы металлов в низших степенях окисления, имеющие возможность повысить степень окисления и координационное число, ведут к гомолитическому расщеплению связи Н-Н. В этом случае дативная компонента связи преобладает над донорно-акцепторной.
IrCl(CO)L2 + H2 ® (H)2 IrCl(CO)L2
Co2(CO)8 + H2 ® 2 HCo(CO)4
2 Co(CN)53-+ H2 ® 2 HCo(CN)53-
В любом из перечисленных вариантов образуются гидридные комплексы переходных металлов. Комплексы такого типа предполагаются в качестве катализаторов и интермедиатов многих процессов с участием водорода.
|
|