
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификации катализаторов
|
|
Существуют различные типы классификации катализаторов, в основе которых лежит определенная совокупность свойств или характеристик. Наиболее широко используется классификация по типу веществ, которые являются катализаторами.
1.3.2.1 Классификация в зависимости от химической природы веществ, являющихся катализаторами. Различают следующие группы катализаторов:
1. Металлы (компактные или массивные, сплавы, скелетные, нанесенные) – гетерогенные катализаторы.
Так, например, металлы VIII группы (Fe, Ni, Co, Pt, Pd) используются в качестве катализаторов гидрирования ненасыщенных соединений (главным образом алкенов, алкинов и ароматических соединений). Серебро является катализатором окисления и окислительного дегидрирования (например, синтез формальдегида из метанола).
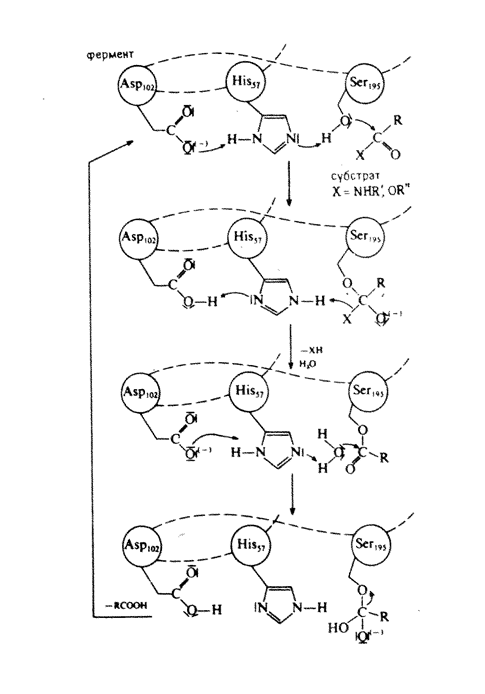 |
Рис. 2. Схема механизма действия химотрипсина
В зависимости от формы и способа приготовления металлические катализаторы могут
быть компактными (массивными), скелетными, нанесенными.
Платиновая сетка (компактный металл в виде переплетенных нитей)– катализатор окисления аммиака в оксиды азота (стадия технологии получения азотной кислоты). Известный катализатор гидрирования – никель Ренея - это скелетный катализатор, который получают при выщелачивании сплава никель-алюминий.
Нанесенные катализаторы – это, например, платина или палладий на активированном угле (Pt/C, Pd/C), палладий на оксиде алюминия (Pd/Al2O3) и т.д.
2. Твердые бинарные соединения металлов МmЭn, где Э – О, S, Se, Te, As, P, C, N, Si, B, гетерогенные катализаторы.
Из этой группы чаще всего используются оксиды или халькогениды металлов полупроводникового типа. Примерами служат оксиды: MgO, ZnO, Fe2O3, Cr2O3, WO3, MoO3, V2O5 и др. Очень большую группу составляют смешанные оксидные катализаторы. Так, в производстве серной кислоты в настоящее время используются катализаторы, основу которых составляет пентаоксид ванадия.
Катализаторы этого типа широко применяют в процессах окисления, гидрирования, дегидрирования, синтезах из синтез-газа. Например, в синтезе метанола катализатором слу-
CO + 2H2 → CH3OH
жит смесь оксидов:
Cr2O3∙ ZnO (высокотемпературный катализатор, суммарное давление газов 25-30 МПа, температура 300-4000С), CuO∙ ZnO∙ Al2O3 (низкотемпературный катализатор, условия более мягкие: суммарное давление 5-10 МПа., температура 220-2700С). Однако, последний катализатор, в отличие от предыдущего, чрезвычайно чувствителен к наличию серосодержащих примесей в исходных газах.
Смесь оксидов молибдена, висмута, железа и фосфора в различных соотношениях с модифицирующими добавками (MoO3∙ Bi2O3∙ Fe2O3∙ P2O5) – катализатор окислительного аммонолиза пропилена в акрилонитрил:
CH2=CH-CH3 + NH3 + 1.5 O2 → CH2=CH-CN + 3H2O
Сульфиды молибдена и вольфрама состава MoxSy + WxSy являются хорошими катализаторами в процессах гидроочистки (обессеривания) нефтяных фракций –– в присутствии этих катализаторов происходит восстановление серосодержащих органических соединений до сероводорода.
3. Кислоты и основания (гомогенные и гетерогенные катализаторы) – протонные кислоты Бренстеда (НА) в водных и неводных средах, апротонные кислоты Льюиса – Усановича (BF3, RI), протонные и апротонные центры твердых оксидов (оксиды алюминия, алюмосиликаты), любые типы оснований (нуклеофильные катализаторы) в том числе твердые – МgO, CaCO3, анионообменные смолы.
На таких катализаторах протекают реакции кислотно-основного катализа, а именно крекинг нефтяных фракций (на алюмосиликатах), дегидратация и гидратация, синтез аминов из спиртов (на Al2O3), этерификация спиртов и кислот, конденсация альдегидов и кетонов, полимеризация ненасыщенных соединений, различного рода поликонденсации, перегруппировки и т.д..
4. Комплексы металлов, включая соли (гомогенные и гетерогенные катализаторы). Следует отметить, что соли переходных металлов – это, как правило, комплексные соединения.
Рассмотрим, например, Вакер-процесс (окисление этилена в ацетальдегид), который протекает в водном растворе системы PdCl2-CuCl2. В твердом виде α -форма хлорида палладия (PdCl2)n является линейным координационным полимером, в котором атомы металла связаны хлоридными мостиками:
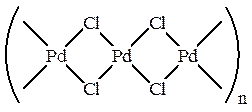
В растворе в присутствии хлорид-ионов он деполимеризуется с образованием плоско- квадратных анионных комплексов палладия и именно эти анионные комплексы являются
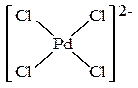
составной частью каталитической системы и участвуют в каталитическом цикле.
В гидрировании алкинов и алкенов активны фосфиновые комплексы родия состава RhCl(PPh3)3.
В процессе карбонилирования метанола в уксусную кислоту (процесс фирмы Монсанто) истинным катализатором являются карбонильные комплексы Rh(I).
Катализатором реакции Реппе (карбонилирование алкинов в присутствии воды (гидрокарбоксилирование), спиртов или аминов) является тетракарбонил никеля состава Ni(CO)4 – довольно лабильный комплекс, имеющий тетраэдрическое строение.
5. Ферменты (гомогенные и гетерогенные).
Ферменты (энзимы) – биологические катализаторы обладают уникальными свойствами: высокой производительностью в расчете на один реакционный центр и селективностью, связанной со специфичностью действия. Работают ферменты в очень мягких условиях, при атмосферном давлении и температуре до 40о (см. выше).
1.3.2.2 Классификация катализаторов по степени дискретности (индивидуальности) и коллективности действия.
Взаимодействие катализатора с реагентами в гомогенно-каталитических процессах носит в основном дискретный характер (взаимодействие с одним активным центром катализатора), особенно при низких концентрациях катализатора. Взаимодействие реагентов с активными центрами на поверхности гетерогенного катализатора подвергается влиянию специфических эффектов твердого тела (большое количество ядер и электронов). Здесь главную роль играют коллективные эффекты. Поэтому катализаторы можно классифицировать по степени дискретности.
Коллективные эффекты выражены сильно в: а) массивных (компактных) металлах, б) твердых растворах (сплавах).
Коллективные эффекты выражены слабее в: а) полупроводниковых оксидах, б) солях металлов в кристаллическом состоянии (HgCl2, MoS2, PdCl2, CuCl).
Дискретные свойства выражены сильно в: а) кислотных катализаторах в растворах, б) комплексах металлов в растворах, в) комплексах металлов, химически связанных с поверхностью носителя. г) твёрдых оксидах непереходных металлов с кислотными свойствами.
Фактически в ряду металлы → оксиды металлов → кислотные катализаторы и комплексные соединения происходит уменьшение влияния коллективных эффектов и увеличение влияния дискретных свойств. Такое деление не полностью совпадает с делением на гомогенные и гетерогенные катализаторы.
1.3.2.3 Классификация катализаторов по специфике электронного строения
1. d–Катализаторы – катализаторы на основе переходных металлов, имеющие d–электроны и энергетически выгодные d–орбитали.
2. s, p-Катализаторы – катализаторы, в активном центре которых находится элемент, имеющий валентные S и P – орбитали(электроны). Это протонные и апротонные кислоты (НХ, RX, R+, BF3, оксиды алюминия, алюмосиликаты), а также основания Бренстеда (O, N, S, P, Hal – содержащие ионы и молекулы).
Металлы побочных подгрупп I и II групп Периодической системы и их соединения относятся к промежуточному типу.
Группа d–катализаторов обладает, несомненно, более широким спектром каталитического действия из-за большего числа энергетически доступных орбиталей: (n-1) d, n s, n p и электронов, участвующих в элементарных стадиях каталитических процессов.
2. ВЫБОР КАТАЛИЗАТОРОВ
2.1 Современное содержание термина «активация»
Все теории катализа старались ответить на следующие вопросы:
- Каким образом катализатор меняет реакционную способность реагентов, обеспечивая их превращение в нужном направлении?
- Как найти катализатор для желаемой реакции?
Ответ на второй вопрос связан с ответом на первый. Современный взгляд на проблему активации имеет в основе химический подход, учитывающий особенности гетерогенного катализа: влияние носителя (коллективные свойства), особенности взаимодействия промежуточных соединений на поверхности гетерогенного катализатора, диффузия адсорбированных молекул в подповерхностные слои катализатора, изменение катализатора под воздействием реакционной среды (реагенты, продукты) и т. д..
Первым четко сформулировал идею «оптимального» взаимодействия между реагентами и катализатором Пьер Сабатье в кн. «Катализ в органической химии» (1913 г.). Энергия образования интермедиата должна быть не слишком мала и не слишком велика. Если реакция образования интермедиата эндотермична, а энтропия понижается, то концентрация интермедиата будет очень мала, а следовательно, скорость стадии его превращения будет низка из-за низкой концентрации. Если образование интермедиата будет очень выгодно, то его концентрация будет велика, скорость его дальнейшего превращения также будет низка из-за низкой реакционной способности, поскольку он очень прочный. И энергия активации стадии его превращения будет велика.
Основы теории координационной химии важны не только для выбора металлокомплексных катализаторов и понимания основ технологии приготовления и регенерации таких катализаторов, но также для понимания процессов, происходящих на поверхности металлических и оксидных гетерогенных катализаторов. Химия поверхностных промежуточных соединений не существенно отличается от химии координационных соединений в растворах. Понимание этого обстоятельства – важнейший результат развития теории каталитической химии во второй половине 20 века.
Так как любой интермедиат в каталитическом процессе – это частица, в которой субстрат связан с металлом-катализатором, то фактически мы имеем дело с координационным соединением. Такому соединению присущи все основные свойства, характеризующие обычные координационные соединения. И поэтому о прочности связи катализатор-субстрат, и об активации субстрата можно судить с тех же позиций, которые применимы в координационной химии для связи металл-лиганд, для характеристики изменений лиганда (т.е. его активации).
Итак, в координационной химии мы имеем дело с металлом-комплексообразователем (или группой металлов – это уже кластерная химия). Атомы, окружающие металл-комплексообразователь, называются лигандами. Лиганды образуют внутреннюю координационную сферу.
Центральный атом и окружающие его лиганды называются комплексом. Важно: комплексы не теряют своих свойств при переходе из одной фазы в другую, например, при растворении соединения внутренняя координационная сфера часто остается без изменений, хотя возможно замещение некоторых лигандов на молекулы растворителя, гидролиз и т.д.
2.1.1 Классификация комплексов
Комплексы классифицируют по различным признакам.
Классификация комплексов по химической специфике лигандов.
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
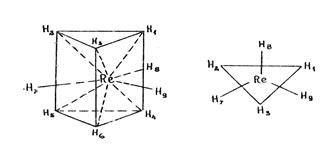
А) Гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9]2- шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
Б) Галогенидные комплексы:
Например, соединение K2PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4)2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:
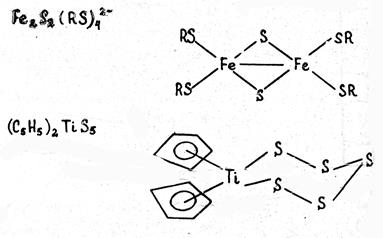
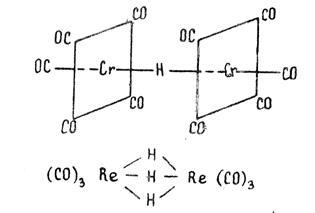
Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н-) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5Cr]2(μ -H) или рения (CO)3Re(μ -H)3Re(CO)3.
: 
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
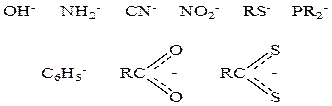
Примером может служить кластерный комплекс платины состава Pt4(OCOCH3)8 :
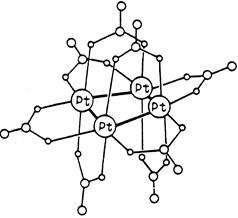
В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи по паре электронов с каждого атома кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N2, O2, CO, NO, NH3, NR3, H2O, R2O, SO2, CS2, PR3, RCN, C6H6
ПРИМЕРЫ:
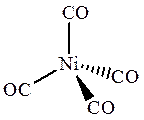
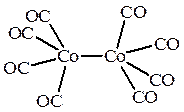
Ni(CO)4 Co2(CO)8
В тетракарбониле никеля Ni(CO)4 атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. Структура биядерного дикобальтоктакарбонила (Co2(CO)8 ) в твердом состоянии содержит две частицы Со(СО)3, связанные двумя карбонильными мостиковыми группами. В растворе Co2(CO)8 «мостиковая» форма находится в равновесии с безмостиковой, показанной выше, в которой каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
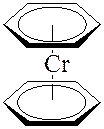
В сэндвичевых соединениях – дибензолхроме (C6H6)2Cr и ферроцене (C5H5)2Fe атом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π -типу:
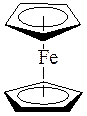
4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:
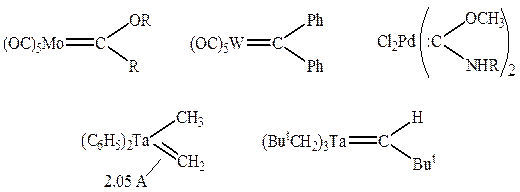
|
|