
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач
|
|
Пример 1. Вычислите: а) массовую долю (ω, %); б) молярную (См, моль/л), в) эквивалентную (Сэ) г) моляльную (Сm) концентрации и титр раствора Н3РО4, полученного при растворении 18 г кислоты в 282 мл воды, если плотность его 1, 031 г/мл.
Решение: а) Массовая доля растворенного вещества А показывает массу вещества, содержащуюся в 100 г раствора:
 или
или 
или 
где m(A) – масса растворенного вещества, г; mр-ля – масса растворителя, г; mр-ра масса раствора, г; Vр-ра – объем раствора, мл; ρ р-ра – плотность раствора, г/мл.
Так как массу воды 282мл можно принять равной 282 г (т. к. плотность воды равна 1г/мл), то масса полученного раствора 18 + 282 = 300 г и, следовательно, 
б) молярная концентрация, или молярность, показывает число молей (υ) растворенного вещества, содержащихся в 1 л раствора:
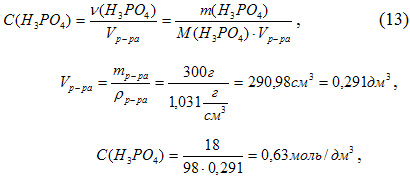
Или См = 0, 63 моль/л
в) эквивалентная концентрация Сэ или нормальность, показывает число моль эквивалентов растворенного вещества В, содержащихся в 1 л раствора:

Найдем мольную массу зквивалента:
μ э (Н3РО4) = μ /3 = 97, 99/3 = 32, 66 г/моль, по п. б) был определен объем раствора V = 0, 291л. Подставив все данные в формулу, получим
18/32, 66 ∙ 0, 291 = 1, 89 моль-экв/л.
г) моляльная концентрация, или моляльность, показывает число молей растворенного вещества А, содержащихся в 1 кг растворителя:

Подставив все данные в формулу, получим 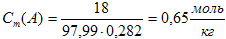
д) титром раствора называется число граммов растворенного вещества А в 1 см3 (мл) раствора:
 или 0, 06185 г/мл.
или 0, 06185 г/мл.
Пример 2. На нейтрализацию 50 мл раствора кислоты израсходовано
25 мл 0, 5н. раствора щелочи. Определить эквивалентную концентрацию раствора кислоты.
Решение: Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной эквивалентной концентрации реагируют в равных объемах. При эквивалентных молярных концентрациях объемы растворов реагирующих веществ обратно пропорциональны их эквивалентным концентрациям, т.е.  , или Сэ(к-ты) ∙ V(к-ты) = Сэ(щ) ∙ V(щ),
, или Сэ(к-ты) ∙ V(к-ты) = Сэ(щ) ∙ V(щ),
тогда 50 · Сэ(к-ты) = 25 · 0, 5, откуда Сэ(к-ты) = 0, 25 моль-экв/л
Пример 3. Сколько литров 96% раствора серной кислоты потребуется для приготовления 20 л 0, 5М раствора серной кислоты?
Решении: Определяем, сколько граммов серной кислоты содержится в 20А 0, 5М раствора:  , отсюда
, отсюда  .
.
Далее находим, в каком объеме 96% раствора серной кислоты содержится 980 г серной кислоты:  , отсюда
, отсюда  , где ρ =1, 84 г/см3. Следовательно, потребуется 0, 54 л 96 %-ного раствора серной кислоты.
, где ρ =1, 84 г/см3. Следовательно, потребуется 0, 54 л 96 %-ного раствора серной кислоты.
Пример 4. К 1 л 10%-ного раствора КОН прибавили 0, 5 л 5%-ного раствора КОН (пл.1, 045 г/cм3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение: Массовая доля растворенного вещества (КОН) равна

Масса одного литра 10%-ного раствора КОН

В этом растворе т 1(КОН)= т р-ра · ω 1(КОН)=1092 · 0, 1=109, 2 г.
Масса 0, 5 л 5%-ного раствора т р-ра2=500 · 1, 045=522, 5 г. В этом растворе т 2(КОН)= т р-ра2 · ω 2(КОН)=522, 5 · 0, 05=26, 125 г.
В общем, объеме полученного раствора (2л) содержание КОН составляет т 1(КОН)+ т 2(КОН)=109, 2+26, 125=135, 325г. Тогда молярная концентрация этого раствора
 Т.е. См(KOH)=1, 21 моль/л.
Т.е. См(KOH)=1, 21 моль/л.
|
|