
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общие реакции на подлинность неорганических лекарственных веществ.
|
|
| Катион, анион | Условия проведения | Эффект реакции |
| Аммоний NH4+ | 1 мл раствора соли аммония (2–6 мг аммоний-иона) нагревают с 0, 5 мл 10 % раствора натрия гидроксида.

| Выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги. |
| Натрий Na+ | А. К 2 мл раствора натриевой соли (7–10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой. Б. Соль натрия, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в желтый цвет. | Образуется плотный осадок белого цвета. |
| Калий K+ | А. К 2 мл раствора соли калия (10–20 мг калий-иона) прибавляют 1 мл 20 % раствора винной кислоты, 1 мл 10 % раствора натрия ацетата, 0, 5 мл спирта 96 % и встряхивают.
 Б. К 2 мл раствора соли калия (5–10 мг калий-иона), предварительно прокаленной для удаления солей аммония, прибавляют 0, 5 мл уксусной кислоты разведенной 30 % и 0, 5 мл 10 % раствора натрия кобальтинитрита.
Б. К 2 мл раствора соли калия (5–10 мг калий-иона), предварительно прокаленной для удаления солей аммония, прибавляют 0, 5 мл уксусной кислоты разведенной 30 % и 0, 5 мл 10 % раствора натрия кобальтинитрита.
 В. Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
В. Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
| Постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах гидроксидов щелочных металлов. Образуется желтый кристаллический осадок. |
| Магний Mg2+ | К 1 мл раствора соли магния (2–5 мг магний-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0, 5 мл 5 % раствора натрия фосфата

| Образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте. |
| Кальций Ca2+ | А. К 1 мл раствора соли кальция (2–20 мг кальций-иона) прибавляют 1 мл 4 % раствора аммония оксалата.
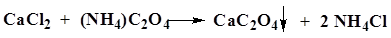 Б. Соль кальция, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
Б. Соль кальция, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
| Образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и 10 % растворе аммиака, растворимый в разведенных минеральных кислотах. |
| Цинк Zn2+ | А. К 2 мл нейтрального раствора соли цинка (5–20 мг цинк-иона) прибавляют 0, 5 мл 2 % раствора натрия сульфида или сероводорода.
 Б. К 2 мл раствора соли цинка (5–20 мг цинк-иона) прибавляют 0, 5 мл 5 % раствора калия ферроцианида.
Б. К 2 мл раствора соли цинка (5–20 мг цинк-иона) прибавляют 0, 5 мл 5 % раствора калия ферроцианида.

| Образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и легко растворимый в хлористоводородной кислоте разведенной 8, 3 %. Образуется белый осадок, нерастворимый в хлористоводородной кислоте разведенной 8, 3 %. |
| Висмут Bi3+ | А. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 3 мл хлористоводородной кислоты разведенной 8, 3 % и фильтруют. К фильтрату прибавляют 1 мл 2 % раствора натрия сульфида или сероводорода.
 Б. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 5 мл серной кислоты разведенной 16 % и фильтруют. К фильтрату прибавляют 2 капли 10 % раствора калия йодида.
Б. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 5 мл серной кислоты разведенной 16 % и фильтруют. К фильтрату прибавляют 2 капли 10 % раствора калия йодида.

| Образуется коричневато-черный осадок, растворимый при прибавлении равного объема азотной кислоты концентрированной. Образуется черный осадок, растворимый в избытке реактива с образованием раствора желтовато-оранжевого цвета. |
| Железо (III) Fe3+ | А. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0, 5 мл хлористоводородной кислоты разведенной 8, 3 % и 1–2 капли 5 % раствора калия ферроцианида.
 Б. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0, 5 мл хлористоводородной кислоты разведенной 8, 3 % и 1–2 капли 5 % раствора аммония тиоцианата
Б. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0, 5 мл хлористоводородной кислоты разведенной 8, 3 % и 1–2 капли 5 % раствора аммония тиоцианата
 В. К раствору соли железа(III) (около 1 мг железо(III)-иона) прибавляют раствор аммония сульфида.
В. К раствору соли железа(III) (около 1 мг железо(III)-иона) прибавляют раствор аммония сульфида.
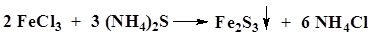
| Образуется синий осадок. Появляется красное окрашивание. Образуется черный осадок, растворимый в разведенных минеральных кислотах. |
| Железо (II) Fe2+ | К 2 мл раствора соли железа(II) (около 20 мг железо(II)-иона) прибавляют 0, 5 мл хлористоводородной кислоты разведенной 8, 3 % и 1 мл 5 % раствора калия феррицианида.

| Образуется синий осадок. |
| Нитраты NO3 | А. К лекарственному средству (около 1 мг нитрат-иона) прибавляют 2 капли раствора дифениламина.

 Б. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают.
Б. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают.
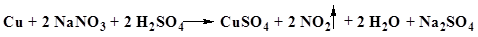
| Появляется синее окрашивание. Выделяются пары бурого цвета. |
| Нитриты NO2- | А. К лекарственному средству (около 1 мг нитрит-иона) прибавляют 2 капли раствора дифениламина (cм. нитраты).
Б. К лекарственному средству (около 30 мг нитрит-иона) прибавляют 1 мл серной кислоты разведенной 16 %.
 В. Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях хлористоводородной кислоты разведенной 8, 3 %, прибавляют 2 капли раствора нитрита (около 1 мг нитрит-иона).
В. Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях хлористоводородной кислоты разведенной 8, 3 %, прибавляют 2 капли раствора нитрита (около 1 мг нитрит-иона).

| Появляется синее окрашивание. Выделяются желто-бурые пары (отличие от нитратов). Появляется зеленое окрашивание (отличие от нитратов). |
| Фосфаты PO43- | А. К 1 мл раствора фосфата (10–30 мг фосфат-иона), нейтрализованного до рН около 7, 0, прибавляют несколько капель 2 % раствора серебра нитрата.
 Б. К 1 мл раствора фосфата (10–30 мг фосфат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0, 5 мл 10 % раствора магния сульфата.
Б. К 1 мл раствора фосфата (10–30 мг фосфат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0, 5 мл 10 % раствора магния сульфата.
 В. К 1 мл раствора фосфата (10–30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл 10 % раствора аммония молибдата и нагревают.
В. К 1 мл раствора фосфата (10–30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл 10 % раствора аммония молибдата и нагревают.
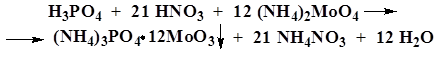
| Образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака. Образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах. Образуется желтый кристаллический осадок, растворимый в 10 % растворе аммиака. |
| Сульфаты SO42- | К 2 мл раствора сульфата (5–50 мг сульфат-иона) прибавляют 0, 5 мл 5 % раствора бария хлорида.

| Образуется белый осадок, нерастворимый в разведенных минеральных кислотах. |
| Сульфиты SO32- | А. К 2 мл раствора сульфита (10–30 мг сульфит-иона) прибавляют 2 мл хлористоводородной кислоты разведенной 8, 3 % и встряхивают.
 Б. К 2 мл раствора сульфита (2–20 мг сульфит-иона) прибавляют 0, 5 мл 5 % раствора бария хлорида.
Б. К 2 мл раствора сульфита (2–20 мг сульфит-иона) прибавляют 0, 5 мл 5 % раствора бария хлорида.

| Постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху. Образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8, 3 % (отличие от сульфатов). |
| Хлориды Cl- | К 2 мл раствора хлорида (2–10 мг хлорид-иона) прибавляют 0, 5 мл азотной кислоты разведенной 16 % и 0, 5 мл 2 % раствора серебра нитрата.

| Образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и растворимый в 10 % растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка проводят после отфильтровывания и промывания осадка водой. |
| Бромиды Br- | А. К 1 мл раствора бромида (2–30 мг бромид-иона) прибавляют 1 мл хлористоводородной кислоты разведенной 8, 3 %, 0, 5 мл 5 % раствора хлорамина, 1 мл хлороформа и взбалтывают.

 Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0, 5 мл азотной кислоты разведенной 16 % и 0, 5 мл 2 % раствора серебра нитрата.
Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0, 5 мл азотной кислоты разведенной 16 % и 0, 5 мл 2 % раствора серебра нитрата.
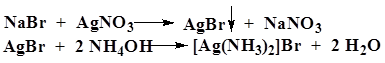
| Хлороформный слой окрашивается в желто-бурый цвет. Образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и трудно растворимый в 10 % растворе аммиака. |
| Иодиды I- | А. К 2 мл раствора йодида (3–20 мг йодид-иона) прибавляют 0, 2 мл серной кислоты разведенной 16 %, 0, 2 мл 10 % раствора натрия нитрита или 3 % раствора железа(III) хлорида и 2 мл хлороформа.
 Б. К 2 мл раствора йодида (2–10 мг йодид-иона) прибавляют 0, 5 мл азотной кислоты разведенной 16 % и 0, 5 мл 2 % раствора серебра нитрата.
Б. К 2 мл раствора йодида (2–10 мг йодид-иона) прибавляют 0, 5 мл азотной кислоты разведенной 16 % и 0, 5 мл 2 % раствора серебра нитрата.
 В. При нагревании 0, 1 г лекарственного средства с 1 мл серной кислоты концентрированной выделяются пары фиолетового цвета.
В. При нагревании 0, 1 г лекарственного средства с 1 мл серной кислоты концентрированной выделяются пары фиолетового цвета.

| При взбалтывании хлороформный слой окрашивается в фиолетовый цвет. Образуется желтый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака. |
| Карбонаты (гидрокарбонаты) CO32- | А. К 0, 2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1: 10) прибавляют 0, 5 мл хлористоводородной кислоты разведенной 8, 3 %
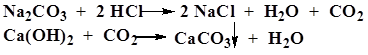 Б. К 2 мл раствора карбоната (1: 10) прибавляют 5 капель насыщенного раствора магния сульфата.
Б. К 2 мл раствора карбоната (1: 10) прибавляют 5 капель насыщенного раствора магния сульфата.
 В. Раствор карбоната (1: 10) при прибавлении 1 капли 1 % раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
В. Раствор карбоната (1: 10) при прибавлении 1 капли 1 % раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
| Выделяется газ, при пропускании которого через раствор кальция гидроксида образуется белый осадок. Образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси). |
Контрольные вопросы и ситуационные задачи
1. С помощью каких химических реакций можно отличить галогенид-ионы друг от друга?
2. Какова окраска образующихся при испытании подлинности осадков сульфидов висмута, ртути (П), железа (II), цинка?
3. Растворы нитратов и нитритов дают одинаковую окраску с раствором дифениламина. С помощью какого реактива можно различить эти анионы?
4. Какими химическими реакциями, можно различить фосфат-, бромид-, иодид-анионы?
5. С помощью каких химических реакций можно отличить карбонат-ион от гидрокарбоната?
6. Какие катионы и анионы идентифицируют с помощью реакций осаждения? Какие реактивы используются для этой цели?
7. Какие катионы можно открыть по окрашиванию бесцветного пламени? Какова методика этого испытания?
|
|