
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксидазный путь биологического окисления. Дыхательная цепь.
|
|
Все ферментыдыхательной цепи, как установлено, связаны главным образом с митахондриями, точнее с их внутренними мембранами. Никотинамидадениндинуклеотидные кофермнты (НАД+, НАДФ +) и некоторые ферменты цикла трикарбоновых кислот находится в матриксе митохондрий. Флавопротеины (ФМН, ФАД), убихинон и цитохромы связаны с липидными структурам и внутренней мембраны. Обычно считается, что на участке между НАД и КоQ осуществляется двухэлектронный перенос, а на участке между цитохромом в и кислородом - одноэлектронный. Следовательно на каждом этапе дыхательной цепи должны участвовать по два цитохрома. Учитывая, что любой компонент дыхательной цепи может восстанавливать редокс- системы только с более высоким потенциалом, а окислить - с более низким, то в целом цепь дыхательных коферментов может быть представлена следующим образом. (Рис 4.)
Матрикс 1\2 О2
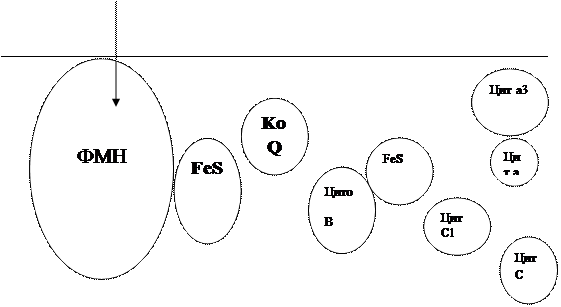 | ||
 |
Межмембранное пространство.
Иногда цепь биологического окисления может быть укорочена. Имеются флавиновые ферменты, например сукцинатдегидрогеназа, которые способны отнимать водород непосредственно от субстрата и передавать его сразу на КоQ. В ряде случаев дыхательная цепь может иметь еще более простое строение. Так, например, оксидазы L- и Д- аминокислот (за исключением глутаматдидрогеназы) такие, как ксантиоксидаза и некоторые другие ферменты катализируют окисление соответствующих субстратов за счет кислорода без участия как НАД + или НАДФ +, так и цитохромов. Эти оксидазы по своей химической природе является флавопротеинами.
Оксидазный путь биологического окисления тесно связана с митохондриями клеток. Колическтво митохондрий в клетках может быть различными. Например, в одной клетке печени (гепатоците) крысы содержится около 1000 митохондрий. Внутреннее пространство, митохондрий (матрикс) окружено двумя непрерывными мембранами: наружная мембрана гладкая, а внутренняя образует многочисленные складки, или кристы. Матрикс митохондрий состоит на 50 % примерно из белка и имеет тонкую структуру. В митохондриях сосредоточено большое количество ферментов. С наружной мембраной связаны ферменты, участвующие в удлинении молекул насыщенных жирных кислот, имеющих от 12 до 16 атомов углерода. Кроме того, в наружной мембране имеются кинуренингидроксилаза и другие ферменты. Моноаминооксидаза может служить маркером ферментом для обнаружения наружной мембраны митохондрий. В межмембранном пространстве митохондрий обнаруживается активность миокиназы (аденилаткиназы) и нуклеозиддифосфаткиназы. Во внутренней мембране митохондрий находиться ферменты дыхательной цепи. Там же находиться следующие ферменты: сукцинатдегидрогеназа (СДГ), бетта - оксибутиратдегидрогеназа, карпитинацилтранфераза и другие.
Важно отметить, что расположение СДГ в непосредственной близости от компанентов дыхательной цепи, объясняет тот факт, что сукцинат окисляется в митохондриях намного быстрее, чем другие субстраты цикла трикарбоновых кислот. Поэтому использование в качестве лекарственного препарата сукцината («Я на») имеет большое практическое значение. В матриксе митахондрий содержатся некоторые ферменты цикла Кребса (цитратсинтазы, изоцитратдегидрогеназа, фумараза, малатдегидрогеназа и др.), ферменты, участвующие в бетта – окислении жирных кислот, глутаматдегидрогеназа, трансаминазы (АЛТ и АСТ) и др.
Чрезвычайно важной функцией дыхательной цепи, связанной с внутренней мембраной, является аккумуляция части освобожденной энергии (около 50 %) в фосфатных связях высокоэргических (или макроэргических) соединений, главным образом АТФ. Процесс сопряжения работы дыхательной цепи (или тканевого дыхания) и фосфорилирования получила название – окислительного фосфорилирования. Впервые в начале 30 – х годов профессор В.А. Энгельгард высказал предположение о наличии сопряжения между фосфолирированием АДФ в аэробном дыхании. Позже В.А.Белицер и соавт. Показали, что синтез АТФ из АДФ и H3PO4, осуществляется в митоходриях при миграции электродов от субстрата к кислороду через цепь дыхательных коферментов. При этом было показано, что отношение Р\О, т.е. число молекул неорганического фосфата, перешедших в органическую форму (АТФ) в расчете на каждый поглощенный атом кислорода равно около 3-х. Далее, было установлено, что уменьшение свободной энергии системы при переносе пары электронных эквивалентов от НАДН2 к молекулярному кислороду составляет 220 кДж. (52, 7 ккал). Величина стандартной свободной энергии образования АТФ из АДФ и H3PO4 находиться в пределах 30, 2 кДж, т.е. 7, 3 ккал.
На основании данных термодинамики была предсказана локализация трех пунктов окислительного фосфорилирования в дыхательной цепи(Ленинджер А., 1980, 1985г.).
По А. Ленинджеру, на трех этапах синтеза АТФ из АДФ и, H3PO4 количество выделяющейся свободной энергии приблизительно совпадает со свободной энергией образования АТФ. Дыхательная цепь представляет собой своего рода «каскал», при помощи которого клетка получает свободную энергию для использования ее на различные виды «работ».
Важную роль в процессе окислительного фосфорилирования играет фермент, встроенный во внутреннюю мемьрану митохондрий; - АТФ – синтаза. Этот ферментный комплекс состоит из двух главных компанентов: Fo и F1. Компанент F1 напоминает “ шляпку гриба” обращенную в сторону матрикса митохондрий “ Шляпка”, чаще называемой головкой, с помощью ножки прикреплена к компоненту Fo, который встроен во внутреннюю мемьрану и пронизывает ее насквозь. Именно эту часть молекулы АТФ – синтазы связывает токсичный антибиотик олигомицин – мощный ингибитор этого фермента и следовательно ингибитор окислительного фосфорилирования.
Компонент АТФ- синтазы F1 был выделен в чистом кристаллическом виде. Его молулярная масса равна = 380000. Молекула F1 состоит из девыти субъединиц пяти разных типов, содержащих несколько связывающих участков для АТФ и АДФ. Удалось также получить в высокоочищенном виде и FoF1 - АТФ – синтазу, названную поэтому, что в изолированном виде она катализирует расщепление АТФ на АДФ и H3PO4. Однако, в интактных митохондриях главная ее биологическая функция заключается не в расщеплении, а в синтезе АТФ из АДФ и H3PO4. Поэтому ее и называют АТФ – синтетазой (или АТФ – синтазой.).
Окончательно детали механизма сопряжения биоэнергетических процессов в митохондриях -дыхания и фосфорилирования – до сих пор, ее выяснены. Большой прогресс в понимании основных принципов биоэнергетики клетки связан с хемиосмотическом синтезом АТФ в биомембранах.
Согластно Митгему, основательно хемиосмотической теории объяснения механизма сопряжения окисления и фосфорилирования (1962,)первичным событием в окислительном фосфорилирования является транслокация протонов (Н+) на наружную сторону сопрягающей (внутренней) митохондриальной мембраны. Это осуществляется за счет процесса окисления в дыхательной цепи, предполагается, что мембрана непроницаема для ионов вообще, особенно для протонов, которые накапливаются на наружной стороне мембраны, создавая по обе стороны мембраны разность электрохимических потенциалов (МН+). Она складывается из химического тотенциала (разность рН) и электрического потенциала (+ У). Разность электрохимических потенциалов обеспечивает действие локализованной в мембране АТФ- синтазы.
Таким образом, нет необходимости в высокоэнергетическом промежуточном соединении, общем для процессов окисления и фосфорилирования.
Предполагается схема, отражающая принципы, лежащие в основе хемиосмотической теории окислительного фосфорилирования.
Межмб. Внутренняя Матрикс мтохондрии
Простр. мембрана
 |  |

 H
H



 S Sох.
S Sох.
+ H





 2Н+ НАДН2 НАД+
2Н+ НАДН2 НАД+
+ -
 + - 2 Н2Оà 2Н+ +2 ОН-
+ - 2 Н2Оà 2Н+ +2 ОН-
 2Н+
2Н+

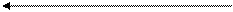 + - 2 Н2Оà 2 Н+ +ОН-
+ - 2 Н2Оà 2 Н+ +ОН-

 + + -
+ + -

 2Н+
2Н+



 1\2 О2 +2Н+
1\2 О2 +2Н+
Н20
Согластно этой схеме, перенос каждой пары электронов от НАДН+ на кислород сопровождается транслокацией 6 протонов с внутренней стороны на наружную сторону митохондриальной мембраны. Вначале НАДН+, забрав 2 протона от субстрата, восстанавливают ФМН в ФМН-Н2. Молекула ФМН является частью большого белкового комплекса, пронизывающего всю толщину внутренней мембраны митохондрии. Это позволяет молекуле ФМНН2 высвободить два протона на наружной стороне мембраны, а затем возвратить два электрона на участки Fe S – белков, которые при этом восстанавливаются.
Каждый восстановленный Fe S - комплекс отдает один электрон молекуле убихинона Q, которая принимая протоны с внутренней стороны мембраны, превращается в QH2. Эта молекула, будучи липидорастворимой, легко перемещается к наружной стороне мембраны, где освобождает пару протонов, а два электрона передает следующему переносчику дыхательной цепи -цитохрому В. Этот переносчик (т.е. комплекс цитохромов В 566 и В562) также пронизывает митохондриальную мембрану, что позволяет ему передавать электроны другой молекуле убихинона, которая одновременно присоединяет еще два протона из матрикса QH2. Совершается еще один челночный рейс на наружную поверхность, где освобождается два протона, а два электрона передаются двум молекулам цитохрома С1. Далее электроны проходят оставшуюся часть цитохромной цепи по мембране до цитохрома а3, находящегося на внутренней стороне мембраны. Здесь два электрона соединяются с двумя протонами из матрикса и атом кислорода, образуя воду.
На поверхности внутренней мембраны находятся также фосфорилирующие субединицы, ответственные за образование АТФ. Они состоят из нескольких белков, в совокупности образующих F1 – субединицу; последняя выступает в матриксе и представляет собой АТФ – синтазу.
F1 – субединицы с помощью «стебелька» связаны с мембраной белковой субединицей Fo, пронизывающей, вероятно, всю мембрану. При прохождении через (Fo –F1)комплекс пары протонов из АДФ и Фн образуется одна молекла АТФ. Сходные фосфорилирующие субединицы находятся, например, на внутренней стороне плазматической мембраны бактерий.
До сих пор, представление о механизме сопряжения пранслокации протонов с синтезом АТФ векторной АТФ – синтетазой имеют в значительной мере предположительный характер. Мемиосмотическая гипотеза Р. Митчела остается наиболее привлекательной для объяснения сопряжения дыхания и фосфорилирования.
Согластно этой теории ионы Н+, выведенные наружу за счет энергии репеноса электронов, снова устремляются внутрь, т.е. в митохондриальный матрикс по протонному каналу Fo. Этот переход ионов Н+ из зоны с более высокой в зону с более низкой их концентрацией сопровождается выделением свободной энергии, за счет которой образуется градиент трансмембранного потенциала (Мн) и синтезируется АТФ. Таким образом можно предположить, что тканевое дыхание «заряжает» митондриальную мембрану, а окислительное фосфорилирование ее «разряжает», используя энергию мембранного потениала для синтеза АТФ.
Гистологическими и гистохимическими исследованиями внутренней мембраняя мембрана митохондрий может быть представлена Рис.2.
 АТФ – синтаза Матрикс
АТФ – синтаза Матрикс
 |
Межмембранное пространство.
АТФ – синтаза
Включает комплекс белков: альфа 3, бетта 3, гамма, Е, ……, Каталитическим центром являются бетта- субединицы. Именно здесь происходит синтез АТФ из АДФ и Фн. Функциями альфа – субединиц являются «прикрытие» бетта- субединиц от воздействия градиентов митохондриального матрикса. Е –субединица регулирует деятельность Fo – протонного канала, ингибируя способность гидролизовать АТФ.
Субстратом для F1 – субединицы АТФ – синтазы является АДФ, Мg+2 и Фн. На рис.3 представлена работа АТФ -синтазы.
АТФ
 |
 Н2О
Н2О
 ОН Н+
ОН Н+



 Н2О
Н2О

 ОН-
ОН-

 Н+
Н+
 |  | ||||||||||
 |  | ||||||||||
 | |||||||||||
 |  | ||||||||||
Межмембранное пространство.
На рис 4 представлена общая схема хемиосмотической теории Р. Митчела в разработке акад. Скулачева В.П. Именно в этой схеме отчетливо видно, как в процессе тканевого дыхания происходит «заряжение» мембраны и роль АТФ – синтазы в ее раздражении.
Межмб. Внутренняя Матрикс мтохондрии
Простр. мембрана
 |  |

 H
H



 S Sох.
S Sох.
+ H






 2Н+ НАДН2 НАД+
2Н+ НАДН2 НАД+
 + -
+ -
 + - 2 Н2Оà 2Н+ +2 ОН-
+ - 2 Н2Оà 2Н+ +2 ОН-

 2Н+
2Н+

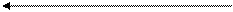 + - 2 Н2Оà 2 Н+ +ОН-
+ - 2 Н2Оà 2 Н+ +ОН-

 + + -
+ + -


 2Н+
2Н+



 1\2 О2 +2Н+
1\2 О2 +2Н+

 Н20
Н20
 | |||
 | |||

 АДФ +Фн+Мg+2
АДФ +Фн+Мg+2
 |


 АТФ+ Н2О
АТФ+ Н2О
 |
Роль трансмембранного электорохимического потенциала (МН+) в обмене веществ исключительно велика, образуясь (мН+) в процессе тканевого дыхания он тратится на транспорт Са +2, Фн, поддержание терморегуляции. В виде схемы биологическая роль трансмембранного потенциала (мН+) представлена на рис 5.
|
|