
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок выполнения работы. Определение массы кислот производится методом кондуктометрического титрования, измеряя электропроводность раствора после каждой порции титранта
|
|
Определение массы кислот производится методом кондуктометрического титрования, измеряя электропроводность раствора после каждой порции титранта. Для этой цели используется прибор – мультитест КСЛ.
1. Для выполнения работы следует поместить в стаканы три исследуемых раствора, содержащих:
а) сильный электролит (0, 01 н HCl) – 20 мл.,
б) слабый электролит (0, 02 н CH3COOH) – 20 мл.,
в) смесь слабого и сильного электролитов (0, 01 н HCl и 0, 02 н CH3COOH) – 20 мл.+20 мл..
2. Встакан с исследуемым раствором опустить электрод, добавить дистиллированной воды столько, чтобы пластинки электродов находились в растворе.
3. Включить прибор, магнитную мешалку и приступить к измерению электропроводности, фиксируя показания прибора после каждой порции титранта. При титровании добавлять по 0, 2 мл. титранта.
Необходимым условием получения достоверных результатов является обязательное перешивание раствора в области электродов. Последовательно провести титрование соляной, уксусной и смеси соляной и уксусной кислот. Все результаты измерений занести в таблицу 1.
Таблица 1
| № п/п | Объем NaOH, мл | Удельная электропроводность, мСм/см | ||
| HCl | CH3COOH | HCl + CH3COOH | ||
| 0, 2 | ||||
| 0, 4 | ||||
| 0, 6 | ||||
| 0, 8 | ||||
| 1, 0 и т.д. | ||||
| титровать до | 3, 0 мл. | 5, 6 мл. | 7, 6 мл. |
Обработка полученных данных:
1. Постройте график в координатах: χ = f (Vтитр.).
2. Найдите точку эквивалентности. Обратите внимание на то, как находятся точки эквивалентности (VNaOH) для смеси кислот.
4. По ниже приведенным формулам рассчитать нормальную концентрацию кислот (соляной и уксусной): 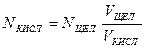 ,
,
где NЩЕЛ – нормальная концентрация раствора щелочи (титранта),
V ЩЕЛ – объем щелочи, пошедший на титрование,
VКИСЛ – объем кислоты, взятый для титрования.
и массу кислот (соляной и уксусной):  . (15)
. (15)
где МЭ – эквивалентная масса анализируемых кислот.
МЭ(HCl) = 36, 5 моль/экв МЭ(CH3COOH) = 60 моль/экв.
Истинное значение массы кислот:
GИСТ(HCl) = 0, 0073 г. GИСТ(CH3COOH) =0, 024 г.
5. Вычислите абсолютную ошибку: D = Gист - Gрасч

и относительную ошибку:
.
Контрольные вопросы
1. Дайте определения следующим понятиям: электролит, неэлектролит, проводники 1-2 рода, общая, удельная и эквивалентная электропровод-ность, числа переноса, подвижность ионов, скорость движения ионов, кондуктометрия, коэффициент активности, степень диссоциации, конс-танта диссоциации.
2. Перечислите методы, которые относятся к электрохимическим. Дайте им краткую характеристику.
3. Прибор Кольрауша, его устройство, принцип работы.
4. Каким образом можно рассчитать константу диссоциации муравьиной кислоты, измерив сопротивление раствора и зная его концентрацию?
5. Закон Кольрауша. Расчет l∞ для растворов сильного электролита.
6. Схема Кольрауша.
7. Что называется постоянной сосуда? Как она определяется?
8. Закон Ома. Что называется удельной и эквивалентной электропровод-ностью?
9. Как, зная сопротивление, можно рассчитать эквивалентную и удельную электропроводность?
10. Чем прямой кондуктометрический анализ отличается от кондуктомет-рического титрования?
11. Какое свойство растворов лежит в основе кондуктометрического мето-да анализа? Прямая кондуктометрия: области применения, достоинства и недостатки.
12. Какие величины можно определить методом прямого кондуктометрии-ческого анализа? Характеристика метода.
13. Что такое подвижность ионов и какую роль она играет в кондуктомет-рическом методе анализа?
14. Установка для кондуктометрического титрования.
15. Приведите схему кондуктометрического титрования. Достоинства и недостатки метода.
16. Каким образом определяется точка эквивалентности в методе кондук-тометрического титрования и каким образом рассчитывается искомая концентрация раствора?
18. Как выглядит кривая кондуктометрического титрования сильного основания сильной кислотой?
19. Как выглядит кривая титрования слабой кислоты сильным основанием?
20. Как выглядит кривая кондуктометрического титрования по реакции осаждения на примере титрования соляной кислоты нитратом серебра?
21. Как выглядит кривая кондуктометрического титрования по реакции осаждения на примере титрования сульфата натрия хлоридом бария?
22. Установка для высокочастотного титрования. Достоинства и недостатки метода.
Литература
1. Крешков А.П. Основы аналитической химии, т. 3. - М.: Химия, 1976.
2. Ляликов Ю.С. Физико-химические методы анализа. – М.: Госхимиздат, 1980.
3. Барковский Ф.Ф., Горелик С.М., Городенцева Т.Б. Физико-химические методы анализа. – М.: Высшая школа, 1972.
4. Бабко А.К., Пилипенко А.Т., Пятницкий И.В. Физико-химические методы анализа. – М.: Высшая школа, 1968.
5. Барковский В.Ф., Горелик С.И., Городенцева Т.Б. Практикум по физико-химическим методам анализа. – М.: Высшая школа, 1963.
Составители: Галина Ивановна Зорина
Першин Валерий Васильевич
Галина Михайловна Курунина
|
|