
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Эквивалентная электропроводность
|
|
Удельная электропроводность зависит от многих факторов. Это не позволяет получать сопоставимые и воспроизводимые результаты. Поэтому лучше пользоваться эквивалентной электропроводностью, отнесенной к 1кг-экв вещества. Найдем связь между удельной (χ) и эквивалентной электропроводностью(λ). Представим себе высокий призматический сосуд с квадратным основанием площадью 1м2, две стенки которого представляют собой пла-
 тиновые (Рt) электроды, а две стенки - стеклянные. Наль-
тиновые (Рt) электроды, а две стенки - стеклянные. Наль-
ем в сосуд электролит на высоту 1м, при этом общая элек-
тропроводность будет равна удельной. W = χ
Увеличивая объем раствора, получим: W = 2χ;
W = 3χ; ……….
и, наконец, W = V× χ,
где V-объем раствора, в котором содержится
|
В этом случае общая электропроводность равна
эквивалентной электропроводности: W = λ v .
И тогда: λ v = V× χ. (6)
Эквивалентной электропроводностью называется проводимость столба раствора, содержащего 1кг-экв электролита, заключенного между электродами, находящимися друг от друга на расстоянии в 1м.
Число м3 раствора, в котором содержится 1кг-экв растворенного вещества называется разведением раствора.
Размерность эквивалентной электропроводности (λ v):
[См × м2 кг-экв-1], [Cм × м2 × кг-экв-1]
Разведение - величина обратная концентрации:  ;
;
Учитывая это, можно записать:
В системе СИ: [Cм × м2 × кг-экв-1]  . (7)
. (7)
В системе СГС: [Cм × см2 × г-экв-1]  . (8)
. (8)
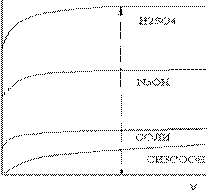
При разбавлении раствора эквивалентная электропроводность может только возрастать, т. к. при разбавлении увеличивается степень диссоциации, а при достижении α = 1, дальнейшее разбавление уже не может увеличить диссоциацию и эквивалентная электропроводность остается величиной постоянной, то есть она стремится к предельному значению (l∞.). (См. рис.4).
Предельное значение эквивалентной электропроводности при степени диссоциации α = 1 называется эквивалентной электропроводностью при бесконечном разбавлении.
Отношение  определяет долю продиссоциировавших молекул. Для сильных электролитов эта величина называется коэффициентом электрической проводимости и определяется по формуле:
определяет долю продиссоциировавших молекул. Для сильных электролитов эта величина называется коэффициентом электрической проводимости и определяется по формуле: 
 ,
,
а для слабых электролитов - степенью диссоциации и рассчитывается по формуле: 
 Эквивалентная электропроводность при бесконечном разбавлении (l∞ ) рассчитается по закону Кольрауша: l∞ = l∞ + + l∞ - (9)
Эквивалентная электропроводность при бесконечном разбавлении (l∞ ) рассчитается по закону Кольрауша: l∞ = l∞ + + l∞ - (9)
 Эквивалентная электропроводность ионов при бесконечном разбавлении является табличной величиной. Для раствора сильного электролита l∞ находят по графику:
Эквивалентная электропроводность ионов при бесконечном разбавлении является табличной величиной. Для раствора сильного электролита l∞ находят по графику:  . Ее находят
. Ее находят
экстраполяцией графика  при большом разведении (рис.4).
при большом разведении (рис.4).
Благодаря электростатическому влиянию ионов друг на друга эффективная концентрация в растворе меньше расчетной и мерой отклонения является степень диссоциации или коэффициент электрической проводимости.
Диссоциация слабых электролитов – это обратимый процесс. При любой температуре в растворе слабого электролита находятся катионы, анионы и молекулы.
Рассмотрим диссоциацию слабого электролита на примере уксусной кислоты: CH3COOH = CH3COO- + H+.
Определяем константу диссоциации по формуле:
 .
.
Допустим, что в V мл раствора содержится а моль вещества уксусной кислоты (CH3COOH), тогда исходная концентрация уксусной кислоты равна:
 .
.
Обозначим через х - число молей CH3COOH, распавшихся на ионы, тогда число ионов будет равно:
 .
.
Число непродиссоциировавших молекул определится как:
 ,
,
отсюда константа равновесия равна:  .
.
Обозначим «Х» через «a».  ,
,
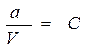 тогда:
тогда:  .
.
Учитывая, что
получаем уравнение, которое называется законом разведения Оствальда:
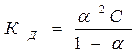 (10)
(10)
для слабых электролитов a < < 0, тогда знаменатель приблизительно равен 1, и упрощенная форма закона разведения Оствальда будет иметь вид:
Кд = a2 × C (11)
Находим отсюда степень диссоциации:  (12)
(12)
Степень диссоциации изменяется обратно пропорционально корню квадратному из концентрации. Так при уменьшении концентрации в 100 раз, степень диссоциации возрастет в 10 раз.
|
|