
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дифференциальные уравнения термодинамики
|
|
Дифференциальные уравнения термодинамики устанавливают количественные характеристики между различными физическими свойствами вещества, вытекающими из основных законов термодинамики. В случае, когда часть параметров оказывается известной, остальные параметры могут быть определены путем интегрирования соответствующих дифференциальных уравнений.
Особенно важным является нахождение частных производных от внутренней энергии ввиду того, что все дальнейшие уравнения и формулы получаются как прямые следствия частных производных внутренней энергии.
Дифференциальное уравнение первого закона термодинамики при независимых переменных V и T имеет вид
 (5.29)
(5.29)
Это уравнение получено после подстановки в уравнение 1-го закона термодинамики
dQ=dU+pdV
полного дифференциала внутренней энергии
 (5.30)
(5.30)
При независимых параметрах p и V полный дифференциал внутренней энергии имеет вид
 (5.30)
(5.30)
Отсюда дифференциальное уравнение первого закона термодинамики при независимых переменных p и V будет
 (5.31)
(5.31)
При независимых параметрах р и Т полные дифференциалы внутренней энергии и объема соответственно имеют вид


Подставляя эти выражения в уравнение первого закона термодинамики, получим

или
 (5.32)
(5.32)
Теплоемкости при постоянных давлении и объеме будут определяться из следующих соотношений (см. формулу (5.13))
 (5.33)
(5.33)
 (5.34)
(5.34)
Найдем частную производную от внутренней энергии по объему. Подставляя в уравнение второго закона термодинамики
 (5.35)
(5.35)
Величину dQ из уравнения (5.29), получим

Сравнивая последнее уравнение с уравнением для полного дифференциала энтропии (при независимых переменных V и Т)
 ,
,
найдем
 (5.36)
(5.36)
 (5.37)
(5.37)
Вычислим вторые производные от полученных соотношений (от первого соотношения по V при T=const, а от второго - по Т при V=const)

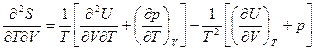
Приравнивая правые части, будем иметь

Отсюда получим


Последнее соотношение представляет частную производную от внутренней энергии по объему. Найдем частную производную от внутренней энергии по температуре. Дифференциальное уравнение первого закона термодинамики (5.32) в изобарном процессе при независимых переменных р и Т имеет вид

или

Отсюда частная производная от внутренней энергии по температуре будет
 (5.39)
(5.39)
Найдем частную производную от внутренней энергии по давлению
Подставим dQ из (5.32) в уравнение (5.35)

Из последнего уравнения с учетом уравнения для полного дифференциала энтропии, а также, исходя из свойств коэффициентов полного дифференциала, находим
 (5.39а)
(5.39а)
 (5.40)
(5.40)
В первом уравнении возьмем производную по р при T=const, а во втором по Т при p=const и приравняем правые части полученного соотношения
 =
=
= 
Отсюда
 (5.41)
(5.41)
Соотношение (5.41) представляет частную производную от внутренней энергии по давлению.
Найдем дифференциальное уравнение теплоты при независимых р и Т. Подставляя (5.39), (5.41), в (5.32), получим

Отсюда

Найдем дифференциальное уравнение энтальпии и энтропии при независимых p и Т. Сравнивая уравнения
TdS=dl-Vdp
и

При независимых переменных p и T, получим
 (5.42)
(5.42)
Сравнивая (5.42) с уравнением для полного дифференциала энтропии вида
 (5.43)
(5.43)
находим
 (5.44)
(5.44)
 (5.45)
(5.45)
Взяв вторые производные по р при T=const в первом уравнении и по T при p=const во втором, будет иметь


Приравнивая правые части, находим
 (5.46)
(5.46)
Из (5.46) получим
 (5.47)
(5.47)
Уравнение (5.47) применяют для анализа изотермических процессов.
Если в уравнение для энтальпии

подставить  из уравнения (5.47) и
из уравнения (5.47) и  из уравнения
из уравнения

то получим
 (5.48)
(5.48)
Если в уравнение для энтропии

подставить 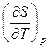 из уравнения (5.33) и
из уравнения (5.33) и  из четвертого соотношения Максвелла
из четвертого соотношения Максвелла
 (5.49)
(5.49)
то будем иметь
 (5.50)
(5.50)
Уравнения (5.48), (5.50) являются дифференциальными уравнениями энтальпии и энтропиии при независимых переменных р и Т.
Таким образом, уравнения
TdS=dU+pdV
TdS=dl-Vdp
объединяющие первый и второй законы термодинамики, позволяют найти следующие важные частные производные
 ;
;  ;
;  ;
;
 ;
;  ;
; 
Найдем зависимость теплоемкости  от давления и
от давления и  от объема при T=const. В уравнении (5.33) возьмем вторую производную по p при T=const
от объема при T=const. В уравнении (5.33) возьмем вторую производную по p при T=const
 (5.51)
(5.51)
В уравнении (5.49) вычислим вторую производную по T при p=const
 (5.52)
(5.52)
Приравнивая (5.51), (5.52), получим
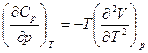 (5.53)
(5.53)
Дифференциальные уравнения для теплоемкостей имеют важное значение в термодинамике и, в частности, уравнение (5.53) используется для получения уравнения состояния реального газа, если из опыта известна зависимость  от параметров.
от параметров.
Точно также можно получить и уравнение для  . Возьмем вторую производную по V при T=const (в уравнении (5.34)
. Возьмем вторую производную по V при T=const (в уравнении (5.34)
 (5.54)
(5.54)
Применяя повторное дифференцирование по T при V=const в третьем соотношении Максвелла
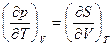
получим
 (5.55)
(5.55)
Сравнивая (5.54) и (5.55), находим Из уравнения (5.33) следует

Из уравнения (5.33) следует

Применяя второе соотношение Максвелла

находим

Точно также, преобразуя (5.34), получим

Применяя первое соотношение Максвелла

будем иметь

Полученные выше дифференциальные уравнения термодинамики связывают величины, которые характеризуют термические и калорические свойства веществ.
По параметрам, определяемым экспериментально, путем интегрирования дифференциальных уравнений можно получить неизвестные термодинамические параметры.
|
|