
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 8
|
|
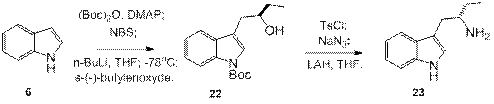
3.1 Модификации реакции Фишера
Все вышеописанные методы объединяет то, что в них происходит формирование только боковой цепи, которая вводится в уже готовый индольный фрагмент, однако есть и другой подход к синтезу триптаминов, который заключается в одновременном формировании индольного и этиленового фрагментов. Большинство из эих синтезов являются модификацией реакции Фишера.
Для синтеза тритамина реакцией Фишера необходимо генерировать фенилгидразон γ -аминобутаналя. Логичнее всего было бы сделать это реакцией фенилгидразина и γ -аминобутаналя, но аминоальдегиды нестабильны, и склонны конденсироваться в 1-пирролины. Пути решения этой проблемы можно объединить в три основные группы (рис. 1).
3.1.1. Защита карбонильной группы γ -аминобутаналя
Первый синтез триптамина основанный на реакции Фишера был осуществлен Эвинсом [1]. Фенилгидразон γ -аминобутаналя в данной реакции генерировался из фенилгидразина 24 и ацеталя альдегида 25. Как было сказано выше, использование ацеталя в этом синтезе необходимо из-за нестабильности аминоальдегида. Данный метод синтеза триптамина накладывает ограничения на введение заместителей в альфа положение этиленового фрагмента, так как исходные соединения нестабильны и малодоступны.
Схема 9.

3.1.2 Защита или использование предшественников аминогруппы.
К этой группе относятся реакции между фенилгидразином и аминоальдегидами с защищенной аминогруппой. Защита аминогруппы позволяет избежать нуклеофильной атаки азота по карбонильной группе и предотвращает циклизацию, что в свою очередь позволяет использовать такие соединения для генерации фенилгидразона γ -аминобутаналя. Примерами таких синтезов являеются перегруппировки фталоилзамещенных гидразонов 26 в соответствующие триптамины 27 [10]
Схема 10.
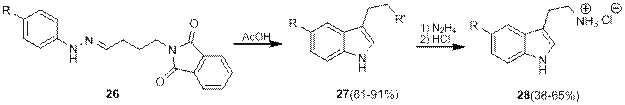
Реакция проходит с хорошими выходами 81-91%. Снятие защитной группы гидразин-гидратом и обработка HCl приводили к образованию гидрохлоридов триптаминов 28
К этой группе также относится множество модификаций синтеза индолов по Фишеру, в которых в реакцию с фенилгидразоном вступают карбонильные соединения, не содержащие аминогруппу. Продуктом этих реакций являются индолы с этиленовым фрагментом, которые вдальнейшем могут быть превращены в триптамины. В литературе можно найти примеры реакций, где в качестве предшественника аминоэтильной группы использовалась хлорэтильная группа. Так, при проведении реакции нитрофенилгидразина 29 с хлорбутаналем 30 выход 2-хлорэтильного производного 31 — предшественника триптамина 32 — оказался низким, что было обусловлено высокой реакционной способностью хлорида и низкой реакционной способностью нитрофенилгидразонов в условиях реакции Фишера [11].
Схема 11.

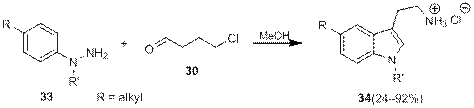
Тем не менее Грандберг и Боброва показали, что при использовании в описанной реакции алкиларилгидразинов 33, алкилирование незамещенного атома азота «галогенидным хвостом» с образованием N -(ариламино)пирролина происходит раньше перегруппировки Фишера, в результате чего образование триптамина 34 происходит в одну реакционную стадию, причем во многих случаях с очень высокими выходами (схема 1.75).
Схема 12.
Приемлемый метод синтеза триптаминов по Фишеру через предшественники аминогруппы был разработан недавно Баскараном и Кенигом [12], которые синтезировали индольный цикл путем взаимодействия гидроксибутаналя 35 с п -метоксифенилгидразином 36 в расплаве эвтектической смеси винной кислоты с диметилмочевиной. Полученный гидроксиэтилиндол 37 далее был превращен в 5 стадий в мелатонин 38 с суммарным выходом 80%.
Схема 13.

Во всех методах синтеза это группы представляется возможным введение заместителя как в альфа так и в бета положения боковой цепи, так как производные исходных бутаналей доступны, но в литературе найдено небольшое количество примеров проведения данных реакций.
3.1.3 Использование соединений, содержащих скрытые формы и карбонильной и аминогруппы
N -замещенные фенилгидразины 39 реагируют с 1-хлор-4-пентином 40 с образованием гидразонов, которые далее превращаются в триптамины 41 по механизму Грандберга.[13] Введение заместителей в этиленовый фрагмент триптамина данной реакцией не представляется возможным, по причине неустойчивости замещенных хлорпентинов.
Схема 14.
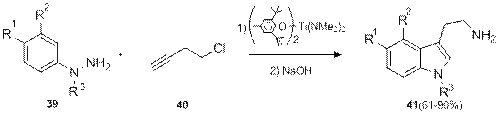
Существует также метод Шапиро-Абрамовича [14], в котором аминогруппа скрыто защищена в лактамном цикле (схема 1.78). При этом гидразон (42) образуется по реакции Яппа-Клингесмана между 2-оксопиперидин-3-карбоновой кислотой, генерируемой из соответствующего этилового эфира 43, и катионом диазония, а перегруппировка протекает с образованием оксокарболина 44. Гидролиз амидной связи и декарбоксилирование дают триптамин 45.
Схема 15.

Относитеольно недавно был разработан метод синтеза триптаминов с помощью тандемной реакции гидроформилирования и синтеза индолов по Фишеру, позволяющий вводить заместители в альфа положение этиленового фрагмента.

Реакция проходит с хорошими выходами и может быть проведена стереоселективно, если использовать оптически активный алиламин. Единственным, но существенным минусом этой реакции является применение дорогостоящих катализатораов.
3.2 Другие способы (Флеминг, Николау)
Существует ряд методов, в которых так же, как и в синтезе по Фишеру, образование пиррольного цикла и аминоэтильного фрагмента происходит одновременно. Флеминг и др. [15] разработали метод синтеза триптаминов 46 из диаминоспиртов 47 под действием аммиака в метаноле (схема 1.81). При этом диаминоспирты синтезировали из аминокетонов 48, которые легко получались присоединением диалкиламинов к арилвинилкетону 49 по Михаэлю.
Схема 16.
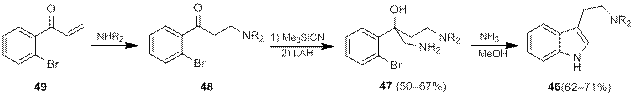
Стратегия синтеза триптаминов, предложенная Николау [16], заключается в последовательном превращении защищенных Boc-анилинов 50 в спирогетероциклы 51, а затем в о -замещенные анилины 52, циклизация которых в условиях кислотного катализа приводит к образованию триптаминов 53, причем при использовнии трифторуксусной кислоты происходит снятие защитной группы, в то время как при использовании концентрированной соляной кислоты снятия Boc-группы не происходит.
Схема 17.

Однако вводить заместитель в боковую цепь триптамина с помощью этих методов представляется сложным, так как эти синтезы накладывают большие ограничения на исходные соединения.
Обсуждение результатов
Разработанная ранее в нашей лаборатории циклопропилиминиевая перегруппировка гидразонов циклопропилкетонов открывает путь к синтезу производных 2-(1H-индол-3-ил)этанаминов (триптаминов) и 1, 4, 5, 6-тетрагидропиридазинов, первые из которых обладают ярко выраженной биологической активностью.

В данной работе были проведены исследования данной перегруппировки с замещенными в циклопропановом фрагменте гидразонами. Для изучения циклопропилиминиевой перегруппировке гидразонов замещенных циклопропилкетонов в качестве модельного вещества был выбран 4-бромфенилгидразин, так как при его реакции с метилциклопропилкетоном (МЦК) триптамин получался с наибольшим выходом и гидразон метилциклопропилкетона генерировался in situ.
Синтез исходных кетонов осуществлялся путем альдольно-кротоновой конденсации ацетона и замещенных бензальдегидов.

Сначала нами был выбран метод, предполагающий использование небольшого количества щелочи(???) и значительный избыток ацетона(). Однако скорость реакции существенно снижалась со временем и при использовании описанного протокола реакционная масса содержала значительные количества промежуточного продукта реакции, что осложняло выделение целевого кетона.
Применение другого метода, предполагавшего значительное количество щелочи(12эквивалентов) и всего 4 эквивалента ацетона позволило упростить процедуру выделения целевого кетона.
Циклопропанирование полученных α -β непредельных кетонов было осуществлено реакцией Кори – Чайковского. Реакции проходили с хорошими выходами. В чистом виде вещества были выделены методом колоночной хроматографии.

Далее перед нами стояла задача подбора условий для циклопропилиминиевой перегруппировке гидразонов замещенных циклопропилкетонов.

Для этой цели в качестве модельного вещества, взаимодействующего с 4-бромфенилгидразином, был выбран фенилзамещенный МЦК. По аналогии с незамещенными циклопропилкетонами перегруппировка была проведена при кипячении в спирте EtOH 4ml на 0, 6mmol кетона в течении 16 часов. После проведения реакции, была проведена экстракция из воды хлороформом. Целевое вещество осталось в водном слое, так как гидрохлориды аминов растворимы в воде и плохо растворяются в хлороформе. С водного слоя был снят ЯМР спектр, по которому можно видеть примесь побочного продукта. Как было выявлено впоследствии, вероятнее всего это вещество - продукт раскрытия циклопропилгидразона по наименее замещенной связи.
После смены растворителя на более полярный ацетонитрил CH3CN и проведения реакции в таких же условиях (4ml растворителя на 0.6 mmol кетона, кипячение в течении 16 часов) облегчилось выделения триптамина, так как Гидрохлориды аминов нерастворимы в ацетонитриле и выпадали в процессе реакции в виде осадка. Снятие спектра ЯМР с этого осадка показало, побочный продукт образуется, но в значительно меньших количествах. Разбавление реакционной массы (8ml ацетонитрила на 0.6 mmol кетона) позволило избежать образование побочного продукта. Данные условия позволяют получать целевой триптамин без примеси побочных продуктов.
При помощи спектроскопией ПМР представляется сложным определить, при каком атоме углерода этиленового фрагмента находится заместитель, то есть реакция пошла по пути раскрытия наиболее или наименее замещенной связи циклопропанового фрагмента гидразона. Или что то про механизм? Но при помощи метода!!!! можно однозначно утверждать, что продуктом исследуемой перегруппировки является триптамин с заместителем в альфа положении этиленового фрагмента. Проведение реакций с большими загрузками и другими заместителями в циклопропановом фрагмента кетона, также показало, что во всех случаях раскрытие циклопропанового фрагмента гидразона проходит по наиболее замещенной связи.
Экспериментальная часть
Спектры ЯМР 1Н и 13С регистрировали на спектрометрах «Brü ker AC-200» (200.13 и 50.3 МГц) и «Bruker AC-300» (300 и 75.5 МГц соответственно) для растворов в CDCl3, (CD3)2SO, содержащих 0.05% Me4Si в качестве внутреннего стандарта. Тонкослойную хроматографию проводили на пластинках Silicagel 60 («Merck»). Для препаративных разделений использовали хроматографию на колонке (силикагель 60, 0.040–0.063 мм, «Merck») при соотношении вещество–сорбент, равном ~1: 100. В реакциях использовали стандартные продажные реактивы и химически чистые перегнанные растворители.
1. Синтнез α -β непредельных кетонов.

В плоскодонную колбу, содержащую 50ml 10% водного раствора NaOH (120mmol) прибавили арилальдегид 1 (10mmol) и ацетон 2 (40mmol). Реакционная масса перемешивалась при комнатной температуре 3 часа, после чего продукт реакции 3 был экстрагирован из воды хлористым метиленом. Органический слой осушили сульфатом магния и упарили.
Все три реакции проходили при загрузке в 5g и продукт в чистом виде выделялся кристаллизацией из системы петролейный эфир/ этилацетат 3: 1.
| R | Продукт реакции | Название соединения | Выход (масса/процент) |
| R = H | 
| ||
| R = Me | 
| ||
| R = F | 
|
|
|