
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пространственная изомерия. 3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия
|
|
3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия. Физические свойства немного различны, химические свойства отличаются не значительно.
Пример: Транс- и цис-2-бром-3-хлорбутены-2 соответственно.

Наличие изомеров обусловлено высоким энергетическим барьером вращения вокруг кратной связи. Термически возможно осуществить переход от менее термодинамически выгодного цис-изомера, к более устойчивому – транс-.
3б Оптическая изомерия (хиральность). В общем случае, изомеры являющиеся зеркальным отражением друг друга, но не способными с помощью операций симметрии совместится. Возможна точечная хиральность (в молекуле содержится один или несколько атомов углерода содержащих четыре разных заместителя), осевая или линейная хиральность (левая и правая спираль с разными концами). Физические свойства одинаковы, кроме способности вращать плоскость плоско-поляризованного света (это свойство присуще только хиральным соединениям и связано с разницей во взаимодействии хиральной молекулы с двумя циркулярными составляющими плоско-поляризованного света). Химические свойства одинаковы, кроме случаев взаимодействия с хиральныи же молекулами.
На этом последнем свойстве основаны методы разделения рацемических смесей хиральных соединений (R: S=1: 1). При взаимодействии рацемической смеси с одним изомером реагента образуются продукты, проявляющие разные физико-химические свойства. Их разделяют с помощью различных методов, а затем регенерируют исходные вещества. Это же свойство используют при проведении стереоселективных превращений органических соединений. Либо используют заведомо чистый оптическиактивный субстрат и применяют реакции, позволяющие сохранить или обратить конфигурацию субстрата, либо при использовании рацемических или нехиральных субстратов используют хиральные катализаторы, добавки или растворители.
Пример: R- и S-1-бром-1-фтор-1-хлорэтаны

По правилам номенклатуры ИЮПАК абсолютные конфигурации точечного оптического (хирального) центра определяют по направлению убывания молекулярной массы трех старших заместителей при этом самый младший заместитель направлен от наблюдателя. Если убывание по часовой стрелке – то R, если против – то S. Правила старшинства заместителей аналогичны используемым в определении Z/E изомеров.

Большинство органических молекул встречающихся в биологических объектах имеют один или несколько оптических (хиральных) центров. Причем, как правило, в природе встречается исключительно один из двух или нескольких изомеров.
Для некоторого упрощения описания строения хиральных молекул была введена т.н. относительная конфигурация (D/L номенклатура) и проекции Фишера. За основу был взят глицериновый альдегид.
Пример: переход от клиновидной проекции D-глицеринового альдегида (R-абсолютная конфигурация) к проекции Фишера.
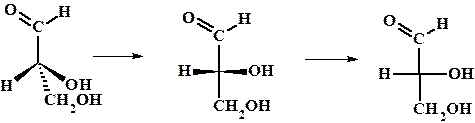
Для L-глицеринового альдегида гидроксильная группа будет располагаться слева.
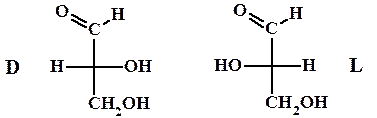
|
|