
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнения изохоры и изобары химической реакции.
|
|
Продифференцируем уравнение изотермы химической реакции (4.15) по температуре:
 ,
,
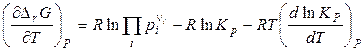 . (4.26)
. (4.26)
Подставим полученную производную 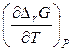 в уравнение Гиббса – Гельмгольца (2.43)
в уравнение Гиббса – Гельмгольца (2.43)

и после сокращения подобных членов получим соотношение:
 , (4.27)
, (4.27)
устанавливающее связь между изменением константы равновесия с температурой и тепловым эффектом реакции, протекающей при постоянном давлении. Это соотношение называют уравнением изобары химической реакции или изобарой Вант-Гоффа.
Для процессов, протекающих при постоянном объёме, можно по аналогии получить уравнение изохоры химической реакции или изохоры Вант-Гоффа:
 . (4.28)
. (4.28)
Уравнения (4.27) и (4.28) в дифференциальной форме выражают изменение константы равновесия с температурой и называются уравнениями Вант-Гоффа. Согласно этим уравнениям влияние температуры на константу равновесия определяется знаком энтальпии реакции Dr Н или изменением внутренней энергии Dr U. Например, при проведении реакции в условиях постоянства давления:
если D rН < 0 (экзотермическая реакция), то повышение температуры уменьшает величину К Р (рис. 1), смещая равновесие реакции влево, т.е. в сторону образования исходных веществ;
 |
если D rН > 0 (эндотермическая реакция), то рост температуры приводит к увеличению К Р (рис. 1), смещая равновесие реакции вправо.
Рис. 1. Влияние температуры на величину константы
равновесия химической реакции.
Для количественной оценки влияния температуры на константу равновесия уравнение изобары (изохоры) (4.27) и (4.28) необходимо интегрировать в требуемом интервале температур (например, считая тепловой эффект в этом интервале температур постоянным и равным стандартному). После интегрирования получаем следующее уравнение:
 , (4.29)
, (4.29)
где  и
и  – константы равновесия при T 1 и T 2,
– константы равновесия при T 1 и T 2,  – средний тепловой эффект реакции в интервале температур от Т 1 до Т 2. На основании уравнения (4.29) можно также рассчитать константу равновесия при любой температуре, если известны тепловой эффект химической реакции и константа равновесия при какой-нибудь одной температуре.
– средний тепловой эффект реакции в интервале температур от Т 1 до Т 2. На основании уравнения (4.29) можно также рассчитать константу равновесия при любой температуре, если известны тепловой эффект химической реакции и константа равновесия при какой-нибудь одной температуре.
|
|