
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Работа рассширения при различных процессах. Энтальпия.
|
|
Рассмотрим работу рассширения, совершаемую одним молем идеального газа, в различных условиях:
1). Изотермический процесс (T = const). Поскольку внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма (закон Джоуля), то
U = const Þ dU = 0, (1.7)
тогда
dQ – dA = 0 Þ dQ = dA = 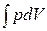 . (1.8)
. (1.8)
Воспользуемся уравнением состояния идеального газа:
pV = RT Þ p =  , (1.9)
, (1.9)
тогда
QT = AT = 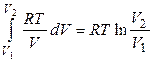 . (1.10)
. (1.10)
Таким образом, работа обратимого изотермического расширения идеального газа совершается только за счет подведенной теплоты.
2). Изохорный процесс (V = const). Следовательно
AV = 0. (1.11)
Тогда
dQV = dU, (1.12)
QV = ∆ U. (1.13)
Вся теплота, подведенная к системе, идет на увеличение внутренней энергии. Таким образом, QV является мерой изменения внутренней энергии (в изохорном процессе работа расширения не совершается).
3). Изобарный процесс (p = const). В соответствии с первым законом
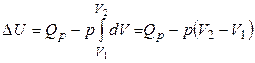 , (1.14)
, (1.14)
или
 , (1.15)
, (1.15)
т. е. не вся теплота, подведенная к системе, идет на увеличение внутренней энергии. Часть ее расходуется на работу расширения.
Последнее выражение можно записать в следующем виде:
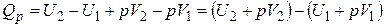 . (1.16)
. (1.16)
Введем новую функцию состояния — энтальпию:
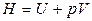 . (1.17)
. (1.17)
Следовательно,
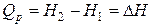 , (1.18)
, (1.18)
т. е. теплота изобарного процесса равна изменению энтальпии.
Изменение энтальпии как функции состояния не зависит от пути протекания процесса, и является полезной величиной при анализе различных термодинамических процессов.
Для химических реакций в газовой фазе справедливо:
QP – QV = ∆ (pV) = ∆ nRT, (1.19)
т. е.
∆ H = ∆ U + ∆ nRT, (1.20)
где ∆ n — изменение числа моль газообразных веществ в ходе реакции.
Итак, ∆ U соответствует тепловому эффекту изохорного процесса, а ∆ H – изобарного.
|
|