
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сұрақ)Газ ретсіз қозғалысы. Еркін жүру жолының орташа ұзындығы. Орташа саны. Эффектив диаметрі
|
|
Газ молекулалары ретсіз қ озғ алып, бір-бірімен ү здіксіз соқ тығ ыста болатындық тан, молекулалардың жылдамдық тары да ә ртү рлі болып, олар жылдамдық бойынша қ андай да бір заң дылық бойынша таралады. Молекулалардың қ озғ алысына ретсіздік, ал олардың соқ тығ ысуларына ық тималдылық тә н болатынына қ арамастан, теория мен тә жірибе олардың жылдамдық тар бойынша таралуы бір ғ ана мү мкін заң дылық бойынша бірмә нді анық талатынын кө рсетті. Ық тималдылық теориясын қ олдана отырып, 1860 жылы Максвелл идеал газ молекулаларының жылдамдық тар бойынша таралу заң ын анық тады: 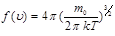

Жылулық қ озғ алыстағ ы газ молекулалары бір-бірімен ү здіксіз соқ тығ ысады. Соқ тығ ысқ анша олар l жолды еркін жү реді. Еркін жү ру жолы — кездейсоқ шама. Тетелес екі соқ тығ ысудың арасындағ ы осы жол ұ зындығ ы ә р тү рлі болады, бірақ молекулалардың саны ө те кө п жә не олардыц қ озғ алысында ешқ андай тә ртіп болмайтындық тан, молекулалардың еркін жолының орташа ұ зындығ ы деген ұ ғ ым ендіреміз, оны λ деп белгілейік. 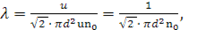 Мұ ндағ ы d — соқ тығ ысу кезінде екі молекула центрлерінің арасын- дағ ы ен аз қ ашыктық тағ ы молекуланың эффективті диаметрі деп аталады. орташа мә ні:
Мұ ндағ ы d — соқ тығ ысу кезінде екі молекула центрлерінің арасын- дағ ы ен аз қ ашыктық тағ ы молекуланың эффективті диаметрі деп аталады. орташа мә ні: 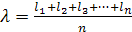
Газдың еркіндік молекулалар саны. Ішкі энергия(34-сұ рақ)
Молекуланың еркіндік дә режесі оның қ ұ рамындағ ы атомдар санына байланысты. Бір атомды газдағ ы молекулалар тек ілгерілемелі қ озғ алыс жасайды, сондық тан оның еркіндік дә режесі ү шке тең. Екі атомды газ молекуласының айналмалы қ озғ алысын ескеру керек. Бірақ екі атомды қ осатын тү зуді айналып қ озғ алғ анын ескермеуге болады. Сондық тан олардың еркіндік дә режесі беске тең болады. Егер молекуладағ ы атом саны екіде артық болса, онда олардың еркіндік дә режесі алты болады. Ішкі энергия жү йедегі барлық микробө лшектердің – атомдар мен молекулалардың қ озғ алыс энергияларынан жә не олардың ө зара ә серлесу энергияларынан қ ұ ралады. 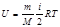 ө рнектен идеал газдың ішкі энергиясы тек температурағ а тә уелді екендігі, яғ ни, ол жү йенің бірмә нді кү й функциясы болатынын кө реміз. Кез - келген жү йенің ішкі энергиясының мә ні оның бұ л кү йге қ алай келгеніне тә уелді болмайды. Сондық тан, жү йе қ андай-да бір процестерден соң бастапқ ы кү йге қ айта оралса, онда ішкі энергияның ө згерісі нольге тең болады:
ө рнектен идеал газдың ішкі энергиясы тек температурағ а тә уелді екендігі, яғ ни, ол жү йенің бірмә нді кү й функциясы болатынын кө реміз. Кез - келген жү йенің ішкі энергиясының мә ні оның бұ л кү йге қ алай келгеніне тә уелді болмайды. Сондық тан, жү йе қ андай-да бір процестерден соң бастапқ ы кү йге қ айта оралса, онда ішкі энергияның ө згерісі нольге тең болады: 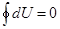 . Олай болса, ішкі энергияның элементар ө згерісі толық дифференциал болып табылады.
. Олай болса, ішкі энергияның элементар ө згерісі толық дифференциал болып табылады.
Заттың жылусыйымдылығ ы. Майер тең деуі. Мольдік жылусыйымдылық (37-сұ рақ)
Заттың жылулық қ асиеттерін сипаттайтын негізгі параметрлердің бірі оның жылусыйымдылығ ы. Заттың жылусыйымдылығ ы 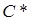 – дененің температурасын 1K-ге ө згертуге қ ажет
– дененің температурасын 1K-ге ө згертуге қ ажет 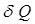 жылу мө лшеріне тең физикалық шама:
жылу мө лшеріне тең физикалық шама:  .
.
Заттың жылусыйымдылығ ы оның массасына, химиялық қ ұ рамына, термодинамикалық кү йіне жә не оғ ан  жылу беру процесіне тә уелді.
жылу беру процесіне тә уелді.
Изохоралық процес с деп газды қ ыздыру немесе суыту процестері тұ рақ ты кө лемде ө тетін процестерді айтады. Мұ ндай процестер ү шін идеал газ кү йінің тең деуін келесі тү рде жазғ ан ың ғ айлы: 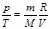 . Термодинамиканың бірінші бастамасы мына тү рде болады:
. Термодинамиканың бірінші бастамасы мына тү рде болады: 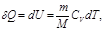
мұ ндағ ы 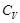 – газдың тұ рақ ты кө лемдегі мольдік жылусыйымдылығ ы.
– газдың тұ рақ ты кө лемдегі мольдік жылусыйымдылығ ы.
Изобаралық процесс деп газды қ ыздыру немесе суыту процестері тұ рақ ты қ ысымда ө тетін процестерді айтады. Мұ ндай процесс ү шін идеал газдың кү й тең деуін оң жағ ында тек тұ рақ ты шамалар қ алатын 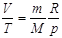 тү рінде жазғ ан ың ғ айлы. Газғ а изобаралық процесс кезінде берілетін шексіз аз жылу мө лшері
тү рінде жазғ ан ың ғ айлы. Газғ а изобаралық процесс кезінде берілетін шексіз аз жылу мө лшері 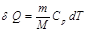 , мұ ндағ ы
, мұ ндағ ы 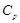 – газдың тұ рақ ты қ ысымдағ ы мольдік жылу-сыйымдылығ ы.
– газдың тұ рақ ты қ ысымдағ ы мольдік жылу-сыйымдылығ ы.
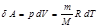

Ө рнектен бір моль зат ү шін жылусыйымдылық ү шін Майер тең деуін алуғ а болады:  .
.
Бұ л тең деудің физикалық мағ ынасы: тұ рақ ты қ ысымда бір моль газдың температурасын 10К арттырғ андағ ы газдың жұ мысы универсал газ тұ рақ тысына тең болады.
Тербелістер. Дифф-дық тең теуі. Жылдамдық. Ү деу(45-сұ рақ)
Тербеліс деп белгілі уақ ыт ө ткен сайын қ айталанып отыратын қ озғ алыстар мен процестерді айтады. Тербелістер физикалық табиғ атына қ арай механикалық, электрмагниттік, электрмеханикалық жә не т.б. болып бө лінеді.
Материалдық нү ктенің тепе-тең діктен ауытқ уы уақ ыт бойынша синус немесе косинус заң ына сә йкес ө згеретін болса, ондай тербелістерді гармониялық тербелістер деп атайды: 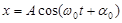 ,
,
мұ ндағ ы: 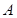 – тербеліс амплитудасы (нү ктенің тепе-тең діктен ең ү лкен ауытқ уы);
– тербеліс амплитудасы (нү ктенің тепе-тең діктен ең ү лкен ауытқ уы); 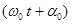
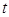 уақ ыттағ ы тербеліс фазасы;
уақ ыттағ ы тербеліс фазасы; 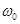 – циклдік жиілік;
– циклдік жиілік; 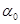 – бастапқ ы фаза,
– бастапқ ы фаза, 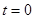 болғ андағ ы тербеліс фазасы.
болғ андағ ы тербеліс фазасы.
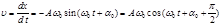 ,
,  .
.
Механикалық гармониялық тербелістердің дифференциалдық тең деуін (6.3) тең деуді тү рлендіру арқ ылы онық тауғ а болады  .
.
Диэлектриктердің поляризациясы (Поляризациялану) (59-сұ рақ)
Сыртқ ы ө ріс ә серінен атомдар, молекулалар немесе кристалл ішіндегі байланысқ ан зарядтардың ығ ысуы ПОЛЯРИЗАЦИЯ деп аталады. Поляризация ә серінен дипольдер пайда болады.
Сыртқ ы электр ө рісінде диэлектриктегі оң жә не теріс зарядтардың қ айта таралып орналасуы диэлектриктің поляризациясы деп аталады.
Диэлектриктің поляризациясын сандық сипаттау ү шін поляризация векторы енгізілген. Бірлік кө лемдегі дипольдік моменттердің қ осындысын поляризация векторы деп атайды. Ө лшем бірлігі 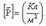
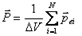 ,
,
Импульс моменті. Импульс моментінің сақ талу заң ы(18-сұ рақ)
Егер  болса, онда
болса, онда 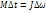
 бұ л қ орытқ ы импульс
бұ л қ орытқ ы импульс
Импульс моментінің сақ талу заң ы: денелер жү йесіне тү сірілген барлық сыртқ ы кү штердің қ орытқ ы импульс моменті жү йенің импульс моментінің ө згерісіне тең. Егер жү йе тұ йық талғ ан болса, сыртқ ы кү штердің қ орытқ ы моменті нө лге тең, яғ ни L=Jω =const, Бұ л импульс моментінің сақ талу заң ы да. Яғ ни, тұ йық жү йедегі импульс моменттерінің векторлық қ осындысы тұ рақ ты болады.
Идеал газ тү сінігі. Газдардағ ы изопроцестер (25-сұ рақ)
Идеал газ деп бір-бірімен ә серлесу кү штері ескерілмейтін, ө зара жә не ыдыс қ абырғ асымен соқ тығ ысулары абсолют серпімді болатын ретсіз қ озғ алыстағ ы материалдық нү ктелер жү йесін айтады. Идеал газдың кү й тең деуі – термодинамикалық параметрлер арасындағ ы функционалдық байланыс: 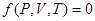 . Кө птеген тә жірибе нә тижелерін қ орыта отырып, Менделеев (1874), бір моль идеал газ ү шін келесі тең деуді анық тады:
. Кө птеген тә жірибе нә тижелерін қ орыта отырып, Менделеев (1874), бір моль идеал газ ү шін келесі тең деуді анық тады: 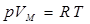 . Мұ ндағ ы
. Мұ ндағ ы 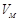 – газдың молярлық кө лемі;
– газдың молярлық кө лемі; 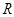 – универсал газ тұ рақ тысы
– универсал газ тұ рақ тысы 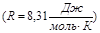 . Массасы
. Массасы 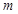 , кө лемі
, кө лемі  идеал газдың кү й тең деуі:
идеал газдың кү й тең деуі: 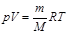 .
. 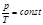 .
.
Изохоралық процесс (V=const) деп газды қ ыздыру немесе суыту процестері тұ рақ ты кө лемде ө тетін процестерді айтады. Мұ ндай процестер ү шін идеал газ кү йінің тең деуін келесі тү рде жазғ ан ың ғ айлы: 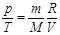 . Кез-келген тепе-тең діктегі процесс ү шін термодинамиканың бірінші заң ын келесі тү рде жазуғ а болады:
. Кез-келген тепе-тең діктегі процесс ү шін термодинамиканың бірінші заң ын келесі тү рде жазуғ а болады: 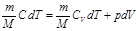 .
.
Бір моль газ ү шін 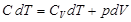 .
.
Изобаралық процесс (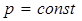 ) деп газды қ ыздыру немесе суыту процестері тұ рақ ты қ ысымда ө тетін процестерді айтады. Мұ ндай процесс ү шін идеал газдың кү й тең деуін оң жағ ында тек тұ рақ ты шамалар қ алатын
) деп газды қ ыздыру немесе суыту процестері тұ рақ ты қ ысымда ө тетін процестерді айтады. Мұ ндай процесс ү шін идеал газдың кү й тең деуін оң жағ ында тек тұ рақ ты шамалар қ алатын 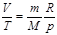 тү рінде жазғ ан ың ғ айлы. Бұ л тең деуден изобаралық процесс ү шін келесі тұ жырымдама жасауғ а болады: газдың берілген массасы ү шін тұ рақ ты қ ысымда кө лем температурағ а пропорционал ө згереді:
тү рінде жазғ ан ың ғ айлы. Бұ л тең деуден изобаралық процесс ү шін келесі тұ жырымдама жасауғ а болады: газдың берілген массасы ү шін тұ рақ ты қ ысымда кө лем температурағ а пропорционал ө згереді: 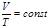 .
.
Изотермиялық процесс деп тұ рақ ты температурада ө тетін термодинамикалық процестерді немесе олардың ұ лғ аюы немесе сығ ылуы кездерінде сыртқ ы орта мен газ арасындағ ы температура айрымы тұ рақ ты болып қ алатын процестерді айтады. Идеал газ кү йінің тең деуінің оң жағ ындағ ы шамалар тұ рақ ты болғ андық тан: 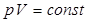 .
.
Бұ л процесте идеал газдың ішкі энергиясы ө згермейді: 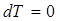 болғ андық тан
болғ андық тан 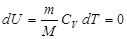
Идеал газдардың молекула-кинетикалық теориясы.Орташа квадраттық жылдамдық (27-сұ рақ)
Идеал газ ү шін молекула-кинетикалық теорияның негізгі тең деуі жү йенің тә жірибеде ө лшенетін р макроскопиялық параметрі мен бө лшектің микроскопиялық параметрін байланыстырады ( ):
): 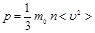 , мұ ндағ ы
, мұ ндағ ы 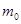 –молекула массы, п –молекулалар концентрациясы;
–молекула массы, п –молекулалар концентрациясы;  – газ молекулаларының ілгерілемелі қ озғ алысының орташа квадраттық жылдамдығ ы (кө п жағ дайда
– газ молекулаларының ілгерілемелі қ озғ алысының орташа квадраттық жылдамдығ ы (кө п жағ дайда  тү рінде белгіленеді).
тү рінде белгіленеді).
Идеал газдың молекула-кинетикалық теориясының негізгі тең деуін келесі тү рде жазуғ а болады:
 .
.
Қ ысым бірлік кө лемдегі молекулалардың ілгерілемелі қ озғ алысының орташа кинетикалық энергиясының 2/3-не тең болады. Олай болса, қ ысым кү штік сипаттама ғ ана емес, энергетикалық сипаттама да болып та табылады.
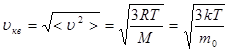
Менделеев-Клайперон тең деуі. Мольдік масса. Зат мө лшері (26-сұ рақ)
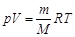 . Бұ л Менделеев – Клапейрон тең деуі. Клайперон тең деуін тағ ы бір тү рде жазуғ а болады:
. Бұ л Менделеев – Клапейрон тең деуі. Клайперон тең деуін тағ ы бір тү рде жазуғ а болады: 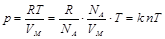 не
не 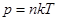 . Заттың мольдің массасы - бір мольдің мө лшерінде алынғ ан заттың массасы.
. Заттың мольдің массасы - бір мольдің мө лшерінде алынғ ан заттың массасы. 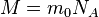 Заттың мольдік массасы заттың салыстырмалық молекулалық массасымен кг/моль қ атынасы арқ ылы байланысқ ан. Заттың кез келген мө лшерінің массасын былай анық тауғ а болады:
Заттың мольдік массасы заттың салыстырмалық молекулалық массасымен кг/моль қ атынасы арқ ылы байланысқ ан. Заттың кез келген мө лшерінің массасын былай анық тауғ а болады: 
Моль - зат мө лшерінің ө лшемі, ол ν (" ню") грек ә рпімен белгіленеді.
 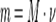 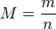
|
Кез келген заттың 1 молінде Авогадро санындай қ ұ рылымдық бірліктер (атом, молекула) болады. Олай болса «моль» дегеніміз Авогадро санындай қ ұ рылымдык бірлігі бар зат мө лшері.
Моль дегеніміз – қ ұ рамында атомдар санына тең қ ұ рылымдық бө лшектер (атомдар, молекулалар) болатын заттың мө лшері.
Денелер жү йесінің механикалық энергиясы (9-сұ рақ)
Механикалық жү йенің кинетикалық энергиясы Массасы  болатын,
болатын, 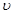 жылдамдық пен қ озғ алып келе жатқ ан дене келесі кинетикалық энергияғ а ие болады
жылдамдық пен қ озғ алып келе жатқ ан дене келесі кинетикалық энергияғ а ие болады 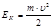 . Басқ аша айтсақ, ж ү йенің кинетикалық энергиясы механикалық қ озғ алыс кү йінің функциясы болады.
. Басқ аша айтсақ, ж ү йенің кинетикалық энергиясы механикалық қ озғ алыс кү йінің функциясы болады.
Кинетикалық энергия дене қ озғ алысының ө лшемі болып, ол дене басқ а денелермен ә серлескенде жасалатын жұ мыс шамасын анық тайды.
Потенциалдық энергия – жү йе бө лшектерінің ө зара орналасуы мен олардың сыртқ ы кү ш ө рістерінде орналасуына байланысты болатын жү йенің механикалық энергиясының бір тү рі.
Егер жү йедегі денелерге қ озғ алу мү мкіндігін берсе, онда дене ішкі кү штердің ә серінен жұ мыс жасайды, ал ол жұ мыс жү йенің потенциалдық энергиясы болады: 1) массасы  болатын
болатын 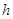 биіктікке кө терілген дененің потенциалдық энергиясы
биіктікке кө терілген дененің потенциалдық энергиясы 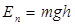 ; 2)
; 2) 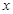 шамасына керілген серіппенің потенциалдық энергиясы
шамасына керілген серіппенің потенциалдық энергиясы 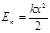 ;
;
Зарядталғ ан ө ткізгіш, конденсатор жә не электростлық ө ріс энергиясы. Оның кө лемдік тығ ыздығ ы(62-сұ рақ)
.
Заряды біршамағ а жеткен ө ткізгіштің 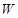 энергиясын ө рнегін интегралдау арқ ылы табуғ а болады:
энергиясын ө рнегін интегралдау арқ ылы табуғ а болады:  .
.
Ө ткізгіш заряды мен потенциалы арасындағ ы тә уелділікті пайдаланып, зарядталғ ан ө ткізгіштің энергиясы ү шін келесі тү рдегі ө рнекті алуғ а болады:
 .
.
ЗАРЯДТАЛҒ АН КОНД-Р ЭНЕРГИЯСЫ. З арядталғ ан конденсатордың толық электрстатикалық энергиясы ү шін ө рнекті жазуғ а болады: 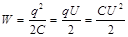 ,
,
 Мұ ндағ ы
Мұ ндағ ы  - конденсатордың ішіндегі электр ө рісінің кернеулігі, ал
- конденсатордың ішіндегі электр ө рісінің кернеулігі, ал 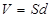 – конденсатордың кө лемі. Бірлік кө лемдегі энергия немесе электр ө рісінің энергиясының кө лемдік тығ ыздығ ы:
– конденсатордың кө лемі. Бірлік кө лемдегі энергия немесе электр ө рісінің энергиясының кө лемдік тығ ыздығ ы: 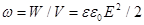 . Бұ дан кө лемдік тығ ыздық электр ө рісінің кернеулігінің квадратына тура пропорционал екені шығ ады.
. Бұ дан кө лемдік тығ ыздық электр ө рісінің кернеулігінің квадратына тура пропорционал екені шығ ады.
|
|