
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Көмір газификациясы процесінің кинетикалық сызбасы.
|
|
Плазмохимиялық реакторларда кө мір ө ң деудің бастапқ ы химиялық сатысы кө мірден ұ шыш заттардың бө лінуі болып табылады. Біріншілік ө німдердің қ ұ рамы жә не олардың кө мірден бө ліну жылдамдығ ы жалын тү зетін газдың температурасы мен қ ұ рамына тә уелсіз екендігі эксперименталды жолмен[125] дә лелденді. Осылайша, бұ л сатыны тү рлі плазмохимиялық реакциялар (пиролиз, гидропиролиз жә не булы газификация) ү шін бір кинетикалық механизм арқ ылы сипаттауғ а болады.
Тү рлі кө мірлерді ИҚ спектроскопия кө мегімен зерттеуолар негізінен функционалды топтардың концентрациясы арқ ылы ажыратылатындығ ы кө рсетілді. Функционалды топтардың бө лінуі мен ыдырауын сол ә діспен зерттеу жә не тү зіоген ө німдердің (CH4, H2O, CO, Н2, CO2 жә не т.б.) концентрациясын анық тау осы функционалды топтардың бө ліну жә не ыдырау реакцияларының жылдамдық константасын жә не олардан соң ғ ы ө німдердің тү зілу жылдамдығ ын береді. Бұ л топтардың бө лінуінің жылдамдық константасы кө мірдің балық типтері ү шін бірдей. Кө птеген кө мірлер ү шін олардағ ы тү рлі функционалды топтардың концентрациясы туалы мә ндер жоқ. Мұ ндай жағ дайда, бірінші жуық тау бойынша кө мір ыдырауында бө лінетін біріншілік ө німдердің қ ұ рамы мен жалпы саны кө мірді жартылай кокстеу ө німдерінің шығ ымының анализінің стандартты ә дістерімен анық талады[22]. Осылайша ұ шқ ыш заттардың қ ұ рамы концентрациясы ә р тү рлі функционалды топтардың жалғ ыз жиынтығ ымен кө рсетіле алады. Модельде кө мір қ ұ рамы органикалық жә не минералды бө ліктерінің суммасы тү рінде кө рсетілген. Органикалық бө лік – функционалды топтардың (CH4, H2O, CO, CO2, Н2, шайыр) жә не кө мірдің жиынтығ ы, ал минералды бө лігі – сә йкес жылу физикалық қ асиеттері бар кү л. 3.1-кестеде [127]-ден алынғ ан жә не осы модельде ұ шқ ыш заттардың кө мірден бө ліну сатысындағ ы кинетикасын сипаттау ү шін қ олданылғ ан химиялық су, сутек, кө міртек оксиді, кө міртек диоксиді, этилен, метан жә не шайыр тү зілу реакцияларының кинетикалық параметрлерінің мә ні келтірілген.
Негізгі міндет ұ шқ ыш компоненттердің жә не кө міртектің арй қ арай ө згерулері кезінде тү зілген ө нім қ ұ рамын есептеу болғ андық тан, «шайыр» термині тү сіндіріп кетуді талап етеді. Кө мір пиролизі кезінде тү зілген шайыр қ ұ рамын зерттеу шайырдың тү зілуіне жү здеген компоненттер қ атысытындығ ын кө рсетті. Шайырдың дә л қ ұ рамы белгісіз. Сондық тан шайырдың тү зілуінің барлық реакцияларын есепке алу мү мкін емес. Осығ ан байланысты, шайыр қ ұ рамын шайыр молекуласының негізгі қ ұ рылымын қ амтитын негізгі компоненттер тү рінде жазу ұ сынылды. Шайырдың негізгі компоненті – бензол (C6H6) [29] деп есептелінеді.
Біріншілік ө німдердің ары қ арай ауысулары (11)-(51) радикалды реакциялармен сипатталады. Олардың константалары [130; 131] жұ мыстардан алынғ ан.
3.1-кесте - реакциялардың кинетикалық параметрлері.
| № п/п | Реакция | lg A | N | Ea |
| 1 | 2 | 3 | 4 | 5 |
| H2T = H2 | 18, 2 | 88, 8 | ||
| H2OT = H2O | 13, 9 | 51, 4 | ||
| COT = CO | 12, 3 | 44, 4 | ||
| CO2T = CO2 | 11, 3 | 32, 6 | ||
| CH4T = CH4 | 14, 2 | 51, 6 | ||
| C6H6T = C6H6 | 11, 9 | 37, 4 | ||
| C + H2O = CO + H2 | 11, 3 | 60, 8 | ||
| C + CO2 = CO + CO | 13, 2 | 83, 6 | ||
| C + O2 = CO2 | 9, 4 | 38, 0 | ||
| C + C + O2 = CO + CO | 9, 7 | 41, 8 | ||
| CH4 + H = CH3 + H2 | 11, 1 | 11, 9 | ||
| CH4 + OH = CH3 + H2O | 0, 5 | 3, 1 | 2, 0 | |
| CH4 + M = CH3 + H + M | 14, 2 | 88, 4 | ||
| CH4 + O = CH3 + OH | 10, 2 | 9, 2 | ||
| CH3 + H2O = CH4 + OH | 9, 8 | 24, 8 | ||
| CH3 + H2 = CH4 + H | 9, 7 | 11, 4 | ||
| CH3 + M = CH2 + H + M | 13, 3 | 91, 6 | ||
| CH3 + O2 = CH3O + O | 10, 7 | 29, 0 | ||
| CH3 + OH = CH2O + H2 | 9, 6 | |||
| CH3 + O = CH2O + H | 11, 1 | 2, 0 | ||
| CH3O + M = CH2O + H + M | 10, 7 | 21, 0 | ||
| CH2O + M = HCO + H + M | 13, 5 | 81, 0 | ||
| HCO + M = H + CO + M | 11, 2 | 19, 0 | ||
| O2 + M = O + O + M | 12, 7 | 115, 0 | ||
| H2 + M = H + H + M | 11, 3 | 96, 0 | ||
| H + O2 = O + OH | 11, 3 | 16, 8 | ||
| H + H2O = H2 + OH | 11, 0 | 20, 3 | ||
| H2 + O = H + OH | 7, 3 | 1, 0 | 8, 9 | |
| H2O + M = H + OH + M | 13, 3 | 105, 0 | ||
| H2O + O = OH + OH | 10, 5 | 18, 3 | ||
| CO + OH = CO2 + H | 4, 1 | 1, 3 | -0, 8 | |
| CO + O2 = CO2 + O | 11, 5 | 37, 6 | ||
| CO2 + H = CO + OH | 6, 2 | 1, 3 | 21, 6 | |
| CO + O + M = CO2 + M | 12, 8 | 4, 1 | ||
| C2H2 + M = C2H + H + M | 11, 0 | 114, 0 | ||
| C2H2 = C + C + H2 | 6, 0 | 30, 0 | ||
| C2H2 + O2 = HCO + HCO | 9, 6 | 28, 0 | ||
| C2H2 + H = C2H + H2 | 11, 3 | 19, 0 | ||
| C2H2 + OH = CH3 + CO | 9, 1 | 0, 5 | ||
| C2H2 + O = CH2 + CO | 10, 8 | 4, 0 | ||
| 3.1-кестенің жалғ асы | ||||
| 1 | 2 | 3 | 4 | 5 |
| CH2 + H2O = CH2O + H2 | 11, 0 | 3, 7 | ||
| CH2 + O2 = HCO + OH | 11, 0 | 3, 7 | ||
| C2H + O2 = HCO + CO | 10, 0 | 7, 0 | ||
| C2H + H2O = CH3 + CO | 9, 1 | 0, 5 | ||
| C6H6 = C2H2 + C2H2 + C2H2 | 12, 0 | 85, 0 | ||
| OH + OH = H2O + O | 9, 5 | 1, 1 | ||
| H + OH + M = H2O + M | 10, 6 | |||
| H + H + M = H2 + M | 9, 6 | |||
| CH2O + OH = HCO + H2O | 10, 5 | 1, 5 | ||
| H + OH = H2 + O | 9, 8 | 7, 0 | ||
| H2 + OH = H2O + H | 11, 4 | 10, 0 | ||
а) Химиялық реакция жылдамдық константасының температурағ а тә уелділігі Аррениус тең деуімен сипатталады:  .
б) 1-6 тең деулер – ұ шқ ыш компоненттердің бө ліну реакциялары.
в) Экспоненциалды кө бейткіштің Aj ө лшемділігі: бірінші ретті реакциялар ү шін - с-1; екінші ретті реакциялар ү шін - 10-3(м3·моль-1·с-1). .
б) 1-6 тең деулер – ұ шқ ыш компоненттердің бө ліну реакциялары.
в) Экспоненциалды кө бейткіштің Aj ө лшемділігі: бірінші ретті реакциялар ү шін - с-1; екінші ретті реакциялар ү шін - 10-3(м3·моль-1·с-1).
|
Кокс қ алдығ ы мен су буы, оттекпен кө міртек диоксиді арасындағ ы ә рекеттесілер ((7)-(10) реакциялар бұ л сатылардың жылдамдық константалары [132]-ден алынды. Жоғ арыда кө рсетілген реакциялардың ә рбірі бірдей элементарлы стадиялардан (реагенттің бө лшек бетіне адсорбциясы, диссоциация, газ фазадаң ы реакциялар, десорбция жә не т.б.) тұ ратын кү рделі процесс болып табылады. Дә лірек механизм бұ л модельде қ арастырылмағ ан. Тек қ ана (7)-(10) реакцияларымен сә йкес ө згерістер қ арастырылғ ан.
Белгілі бір жағ дайларда (7)-(10) реакциялар кинетикалық ауданда диффузия жылдамдығ ына тә уелсіз жылдамдық пен жү реді. Басқ а жағ дайда диффузия жылдамдығ ы процесс жылдамдығ ын едә уір тө мендете алады. (7)-(10) реакциялар бірінші кинетикалық реттілікке сә йкес ө теді деген болжам бар. Яғ ни, химиялық реакция жылдамдығ ы циясына тура пропорционал. Бұ л жағ дайда негізгі мү ше  , мұ ндағ ы
, мұ ндағ ы  - химиялық реакция жылдамдығ ының келтірілген константасы. Ол химиялық реакцияның жылдамдық константасымен jth масса алмасу коэффициентітінің kj мә ндеріне тә уелді. Жә не кеуекті қ ұ рылымдар бө лшектерінде ө тетін реакцияларды ескереді:
- химиялық реакция жылдамдығ ының келтірілген константасы. Ол химиялық реакцияның жылдамдық константасымен jth масса алмасу коэффициентітінің kj мә ндеріне тә уелді. Жә не кеуекті қ ұ рылымдар бө лшектерінде ө тетін реакцияларды ескереді:  , мұ нда
, мұ нда  жә не
жә не  - бө лшектің ішкі жә не сыртқ ы меншікті беттері, l [м-1], α j –реакцияның ену терең дігі, м;;
- бө лшектің ішкі жә не сыртқ ы меншікті беттері, l [м-1], α j –реакцияның ену терең дігі, м;;  - массалық алмасу коэффициенті, м·с-1; Di - i -компоненттің бө лшекке қ атысты диффузия коэффициенті, м2·с-1; i индексі диффузиясы есепке алынатынO2, CO2, H2 компоненттерін білдіреді. Масса алмасу коэффициенттері Ленард-Джонс [133] молекула ішілік ә рекеттесудің потенциалды функциясын жә не Нуссельттің келесідей диффузиялық санын: Nudif=2+0, 65 Re 1/2 Pr 1/3dif, Прандтль диффузиялық санын: Prdif=η /(ρ gDi) [134, 135] ескере отырып есептелінген.
- массалық алмасу коэффициенті, м·с-1; Di - i -компоненттің бө лшекке қ атысты диффузия коэффициенті, м2·с-1; i индексі диффузиясы есепке алынатынO2, CO2, H2 компоненттерін білдіреді. Масса алмасу коэффициенттері Ленард-Джонс [133] молекула ішілік ә рекеттесудің потенциалды функциясын жә не Нуссельттің келесідей диффузиялық санын: Nudif=2+0, 65 Re 1/2 Pr 1/3dif, Прандтль диффузиялық санын: Prdif=η /(ρ gDi) [134, 135] ескере отырып есептелінген.
(7)-(10) –реакциялардың жү ру режимін бағ алау ү шін [136] –да ұ сынылғ ан критерийлер қ олданылды:
 – кинетикалық режим,
– кинетикалық режим,
 – ауыспалық режим,
– ауыспалық режим,
 – диффузиялық режим.
– диффузиялық режим.
Физикалық тұ рғ ыдан кинетикалық режим бө лшек бетіндегі химиялық реакцияның жылдамдығ ы реагенттің бө лшекке диффузия жылдамдығ ына қ арағ анда ә лдеқ айда аз болғ ан кезде сыртқ ы кинетикалық ауданда қ олданылады. Химиялық реакцияның жылдамдығ ы реагенттің бө лшекке диффузия жылдамдығ ына қ арағ анда жоғ ары болса, диффузияның сыртқ ы ауданында диффузиялық режим іске асырылады. Егер, реагентті бетке алын келу жылдамдығ ы мен беттегі химиялық реакция жылдамдығ ы сә йкес келетін болса, процесс ауыспалы ауданда ө теді. Ұ шқ ыш заттар бө ліну нә тижесінде кө мір бө лшектерінде кеуектер пайда болғ анда химиялық реакция мен реагенттер диффузиясын тек қ ана бетте емес, кеуектерде де орын алады деп қ арастыруымыз керек.
Бө лшектерге газдың диффузиясынның жылдамдығ ы келесідей:
Wdif=β iSl(CV-CS), (3.11)
Мұ нда: CV жә не CS – жалпы кө лемдегі жә не бө лшектің бетіндегі газ компоненттерінің концентрациялары.
Бө лшектегі (7)-(10) нхимиялық реакциялардың жылдамдығ ы:
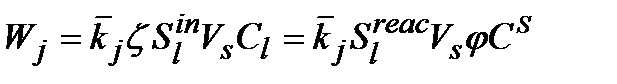 (3.12)
(3.12)
Мұ нда:  - бө лшектің ішкі реакциялық бетінің толық ішкі бетіне қ атынасы. [137] жұ мыстағ ы ұ сыныстарғ а сә йкес кө мір бө лшектері ү шін бұ л қ атынас 5 %-ғ а тең, яғ ни
- бө лшектің ішкі реакциялық бетінің толық ішкі бетіне қ атынасы. [137] жұ мыстағ ы ұ сыныстарғ а сә йкес кө мір бө лшектері ү шін бұ л қ атынас 5 %-ғ а тең, яғ ни  жә не
жә не  - бұ л ә рекеттесу эффективтілігінің коэффициенті деп аталады.
- бұ л ә рекеттесу эффективтілігінің коэффициенті деп аталады.
Cl ү шін келесі формула қ олданылады:

мұ нда, r –бө лшектің радиусы бойымен центрінен бетіне дейінгі арақ ашық тығ ы.
Vs φ -ге кө бейтілгенде ә рекеттесетін бө лшек кө лемінің бө лігін аламыз. Wdif=Wj болғ анда CS мә нін аламыз:
 ,
,  , мұ нда, kD=β iSl. (3.13)
, мұ нда, kD=β iSl. (3.13)
|
|