
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сущность процесса
|
|
При растворении в воде соли, кислоты и щелочи начинают распадаться на группы частиц или отдельные частицы, которые несут положительные и отрицательные заряды. Данные частицы называются ионами, а раствор – электролитом. Гальваническими ваннами, называются устройства, в которых за счет внешней электрической энергии происходят химические превращения веществ.
Если в гальваническую ванну с электролитом на определенном расстоянии друг от друга расположить два токопроводящих электрода и от внешнего источника тока подать на эти электроды некоторую разность потенциалов, то в межэлектродном пространстве начнется перенос диссоциированных частиц. Электрод, который был присоединен к положительному полюсу источника тока, имеет название анода, а к отрицательному – катода (рисунок 2.1).
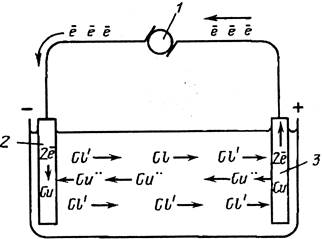

Уже после влияния гальванического поля разноименно заряженные ионы перемещаются – элемент к катоду (катионы), элемент к аноду (анионы). Катионами, равно как закон, считаются ионы металлов и водорода, анионами – кислотные части. Подходя к катоду, ионы сплава, к примеру железа, присутствие конкретном потенциале присоединяют к для себя электроны и преобразуются в атомы железа, какие садятся в поверхности. В то же время в катоде совершается ряд ионов водорода, сформировавшиеся атомы отчасти поглощаются железным покрытием, а отчасти рекомбинируются в молекулы и удаляются с поверхности катода.
Применяя в свойстве катода заранее расчищенные и специализированные к возмещению потертые элемента автомобилей, в их плоскость возможно, подобным способом, делать прямые, износостойкие слои железа, хрома либо иных металлов.
На катоде помимо осаждения сплава проходят сопутствующие движения: выделение водорода, возобновление сплава вплоть до наиболее невысокой валентности, возобновление органических элементов, попавших в электролит. По этой причине реальная вес элемента, выделившегося в катоде, станет менее массы элемента, вычисленной согласно составе (2.1). Подход массы действительно выделившегося металла в электроде к на теоретическом уровне возможному его числу именуется выходом по току Катодный (или анодный) выход веществ по постоянному току (α) определяют по формуле:
 (2.1)
(2.1)
Масса фактически осевшего вещества на катоде
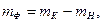 (2.2)
(2.2)
где mH – масса детали до нанесения покрытия, г; mК – масса детали после нанесения покрытия металла, г.
Значения α для железнения составляет 80...90%
Толщину гальванического покрытия (h, мкм), необходимую для выполнения всех операций по восстановлению детали до требуемого размера (d), определяют из следующей зависимости:
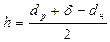 , (2.3)
, (2.3)

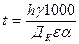 , (2.4)
, (2.4)

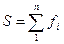 , (2.5)
, (2.5)

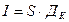 . (2.6)
. (2.6)

этом в прикатодной области происходит перенасыщение ионов, расходуемых на построение выделяемого вещества (металла, пузырьков водорода). Одновременно возникает дополнительный скачок потенциала на границе металл - раствор, называемый электродной поляризацией.
Величина поляризации зависит от истинной плотности тока. Поляризацию (φ) определяют как разность между потенциалом электрода под током (φ i) и равновесным потенциалом (φ р), т. е.
 . (2.8)
. (2.8)
Из уравнения (2.8) видно, что при неизменном электродном потенциале (φ =const) поляризация может увеличиваться или уменьшаться и принимать бесчисленное множество различных значений в зависимости от равновесного потенциала. Сдвиг потенциала при протекании тока, обусловленный медленностью стадии разряда-ионизации, называется электрохимической поляризацией, или перенапряжением разряда.
В связи с свойств системы электрод – электролит поляризационные явления имеют все шансы формироваться быстротой перемещения ионов (дифузная поляризование) либо исключительно химической стадией реакции (химическая поляризование). Данные 2 типа поляризации связывают под единым наименованием концентрационная поляризование.
Электродную поляризацию, сопряженную с затруднением перехода электрона к иону либо с имя (химическое стресс), с замедленностью периода возведения формирующейся кристальной сетки сплава либо газовых пузырьков (фазисная либо кристаллизационная поляризование), как правило причисляют к активационной поляризации.
Большое роль присутствие электроосаждении металлов обладает проявление перенапряжения водорода, образующееся из-за синхронного разряда ионов металла Н+ либо Н3О+. Данный второстепенный процедура сокращаяет вывод сплава согласно току и затрудняет службу электрических ванн. Уровень кислотности либо щелочности растворов определяет коэффициент водородных ионов (рН). Эта мера предполагает собою негативный логарифм числа гр-ионов водорода, приводящегося в 1 литр раствора. Таким образом, в 1 литре дистиллированной вода заключается 0, 0000001 г-ионов водорода. Таким образом, коэффициент инициативности водородных ионов данного раствора рН= –lg10-7=7. С повышением кислотности раствора рН снижается.
В ходе электролитного отделения металла с раствора роль рН, равно как принцип, меняется. С целью укрепления постоянства данного признака в некоторых случаях в католит включат буферирующие элемента, какие готовы порождать формирование новейших ионов водорода либо объединять снова образующиеся ионы. Данное содействует получению осадков сплава с одними и теми же согласно толщине качествами.
Основная сфера использования электрических напыления в ремонтном производстве – возобновление множественных деталей с незначительным износом, однако с значительными условиями к износостойкости, твердости и сплошности возмещения и стабильности его объединения с базой (изображение 2.2).Учитывают, что 65% деталей ремонтного фонда имеют износ на сторону 0, 14 мм. Гальванические покрытия наносят на восстанавливаемые поверхности клапанов, поршневых пальцев, шатунов, отверстий под подшипники в корпусных деталях и др.
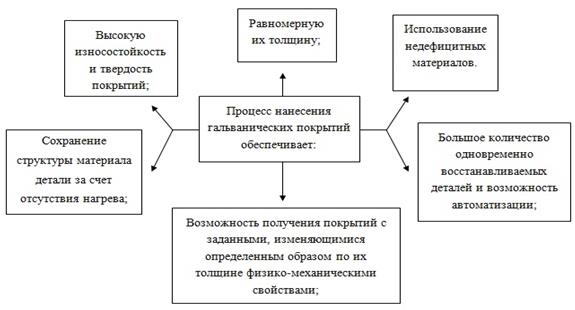
Рисунок 2.2 – Функции гальванического покрытия
Но быстроту нанесения покрытий невысокая (электрический процедура наиболее продолжительный согласно сопоставлению с иными действиями нанесения покрытий). Ход трехоперационный и сопутствуется расходом воды и засорением канализационных вод ионами опасных металлов. Метод потребует улучшения в направленностях увеличения производительности и снижения расходов в использованные материалы. Наравне с данным синхронная обрабатывание значительного числа элементов в одной ванной комнате существенно уменьшает отдельную первоначальная стоимость нанесения покрытий, то что прибыльно выделяет данный процедура с иных методов возобновления деталей.
В исправительном изготовлении отыскали использование соответствующее электрические движения: железнение, хромирование, оцинкование, кадмирование, никелировка и др. Максимальное продвижение приобрел процедура железнения. Он гарантирует приобретение абразивостойких покрытий, а В связи с зоны электролиза движения разделяются в комнатные и вневанные, а в связи с температуры электролита электролиз проходит в теплых (наиболее 50°С) либо холодных (приблизительно 20°С) электролитах
|
|