
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Конфигурационная стереоизомерия молекул с двумя и более центрами хиральности. s,p–диастереомерия. Свойства энантиомеров и диастереомеров.
|
|
Стереоизомсры — это соединения о одинаковым строением, т. е. одним п тем же порядком соединения атомов, но отличающиеся расположенное тех же атомов в пространстве. С позиции их относительной устойчивости стереоизомеры разделяют на конфигурационные и конформационные. С позиции представлений симметрии все стереоизомеры разделяют на энантиомеры и диастереомеры.
σ -Диастереомеры. В виде диастереомеров могут существовать соединения, молекулы которых имеют два и более центра хиральности. С увеличением числа асимметрических атомов углерода число стереоизомеров удваивается с появлением каждого нового центра хиральности и может быть вычислено по формуле N = 2n, где N— число стереоизомеров, а п — число центров хиральности. Молекулы с двумя 12С* могут существовать в виде 4-x стереоизомеров. Например, для хлорояблочной кислоты.
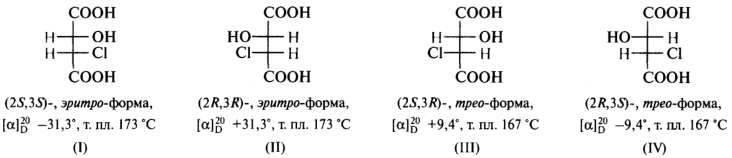
Пары стереоизомеров (I) и (II), а также (III) и (IV) относятся друг к другу как предмет и несовместимое с ним зеркальное изображение, т. е. являются парами энантиомеров. Стереоизомеры в любых других парах являются диастереомерами. Так, в паре (I) и (III) атомы С-2 имеют одинаковую конфигурацию, тогда как атомы С-3 — противоположную; подобная же ситуация наблюдается в парах (I) и (IV), (II) и (III), (II) и (IV). В проекционных формулах (I) и (II) одинаковые лиганды (атомы водорода) находятся по одну сторону проекции, такие стереоизомеры называют эритро-формами. В формулах (III) и (IV) эти же лиганды находятся по разные стороны вертикальной линии проекции Фишера, соответствующие им соединения называют трео-формами.
В молекулах, имеющих несколько 12С*, конфигурация каждого центра хиральности по R, S-системе обозначается отдельно по тем же правилам, что и для соединений с одним центром хиральности.
В отличие от энантиомеров, диастереомеры имеют различия в физических и химических свойствах. Они отличаются температурами плавления и кипения, имеют разную плотность, показатели преломления, растворимость, дипольные моменты. Оптическая активность диастереомеров, представляющих собой хиральные молекулы, отличается по знаку и по величине угла. Диастереомеры с разной скоростью реагируют с одинаковыми веществами. Более того, из диастереомеров могут образовываться разные по строению вещества.
мезо- Соединения. В тех случаях, когда асимметрические атомы углерода имеют одинаковое окружение, общее число конфигурационных стереоизомеров не отвечает формуле 2п. Так, винная кислота с двумя 12С* в молекуле должна бы существовать в виде четырех конфигурационных стереоизомеров, однако для нее известны только три индивидуальных стереоизомера: (2R, 3R)- и (2S, 3S)-винные кислоты, а также оптически недеятельная мезовинная кислота. Известен лишь один рацемат — виноградная кислота. Отсутствие оптической активности у мезовинной кислоты объясняется тем, что ее молекула ахиральна, потому что имеет плоскость симметрии, проходящую через середину связи С-2—С-3:

Необходимо отметить, что хиральные молекулы могут иметь оси симметрии n-го порядка. Так, у оптически активных винных кислот имеются оси симметрии второго порядка С2. При повороте вокруг этих осей на 180° все точки молекул занимают положения, аналогичные тем, которые они занимали перед выполнением операции симметрии. Асимметричные молекулы (типа бутанола-2) не имеют элементов симметрии (кроме осей первого порядка С1, присущих любым телам):

У соединений с тремя центрами хиральности и одинаковым набором заместителей у 12С* число индивидуальных стереоизомеров также не соответствует расчетному. Например, спирты, образующиеся при восстановлении пентоз, имеют в своих молекулах по три асимметрических атома, но вместо восьми конфигурационных стереоизомеров имеют лишь четыре: две оптически активные формы — D- и L-арабиты — и две мезо-формы — рибит и ксилит:

У оптически активных арабитов атом С-3 не является асимметрическим, поскольку соединен с двумя группами С*Н(ОН)СН2ОН, имеющими одинаковое строение и одинаковую конфигурацию центра хиральности. У мезо-форм — рибита и ксилита — периферические 12С* С-2 и С-4 имеют противоположные конфигурации, поэтому заместители С*Н(ОН)СН2ОН уже не будут полностью идентичными, из-за чего С-3 следует рассматривать как 12С*. Такие атомы углерода называют псевдоасимметрическими и обозначают строчными буквами r и s. В молекуле рибита С-3 имеет s-конфигурацию, в молекуле ксилита — r-конфигурацию. Поскольку в системе Кана-Ингольда-Прелога заместитель с R-конфигурацией имеет преимущество перед заместителем с S-конфигурацией, то группа С*Н(ОН)СН2ОН с R-конфигурацией старше группы с S-конфигурацией. Однако из-за того, что молекулы рибита и ксилита имеют плоскость симметрии σ, то в целом они ахиральны:

Диастереомерия циклических соединений. Стереоизомерия циклических соединений имеет ряд особенностей. Так, в циклоалканах с двумя и более заместителями пары заместителей могут располагаться как по одну, так и по разные стороны условно плоских циклов. В первом случае говорят о цис-расположении лигандов, в другом транс-. По отношению друг к другу такие стереоизомеры являются диастереомерами. Приставки цис- и транс- используют применительно только к дизамещенным циклам. Для соединений с тремя и более заместителями применяют более сложную систему обозначения конфигурации.
Молекулы замещенных циклоалканов могут быть ахиральными и хиральными. Например, молекула циклопропан-1, 2-дикарбоновой кислоты имеет два асимметрических атома углерода и, следовательно, должна бы существовать в виде четырех конфигурационных изомеров. Однако в молекуле цис-циклопропан-1, 2-дикарбоновой кислоты имеется плоскость симметрии. Вследствие этого молекула ахиральна и представляет собой мезо-форму. транс-Изомер существует в виде пары энантиомеров, его молекулы хиральны и не имеют плоскостей симметрии. Для обозначения конфигурации асимметрических атомов углерода в замещенных циклоалканах можно применять R, S-систему.
В полициклических насыщенных системах число асимметрических атомов обычно велико и общее число стереоизомеров часто не отвечает формуле N = 2п. Это обусловлено тем, что существование некоторых стереоизомеров даже теоретически невозможно. Так, молекула 3-бромо-5-метиладамантан-1- карбоновой кислоты имеет в своем составе четыре асимметрических атома углерода; несмотря на это для данного соединения известна лишь одна пара энантиомеров. Ни у одного из четырех центров хиральности нельзя поменять конфигурацию, не нарушив жесткую структуру адамантана:

π -Диастереомеры. Алкены и их производные с общей формулой ABC=CDE могут существовать в виде π -диастереомеров. Они возникают при условии неидентичности лигандов, связанных с отдельными атомами углерода двойной связи, т. е. должны выполняться условия А ≠ В, D ≠ Е. π -Диастереомеры отличаются друг от друга различным расположением лигандов относительно плоскости симметрии π -связи. Для обозначения диастереомеров этого типа используют префиксы цис- и транс-. У цис-изомеров одинаковые лиганды расположены по одну сторону плоскости симметрии, у транс-изомеров — по разные стороны. Молекулы π -диастереомеров ахиральны, имеют как минимум одну плоскость симметрии (плоскость, в которой лежат σ -связи sp2-гибридизованных атомов углерода), π -Диастереомеры отличаются друг от друга физическими и химическими свойствами, например:

цис-транс-Изомеры существуют потому, что свободное вращение вокруг двойной связи не происходит, иначе неизбежно нарушилась бы π -связь:

Принцип старшинства заместителей (правило последовательности) лежит в основе E, Z-cucmeмы, применяемой для обозначения конфигурации двойных связей цис- и транс -изомеров. Для этого в парах лигандов, соединенных с каждым из атомов двойной связи, определяют старшинство заместителей. Если старшие заместители каждой пары находятся по одну сторону двойной связи, то конфигурацию обозначают префиксом (Z)-, в том случае, когда старшие лиганды находятся по разные стороны плоскости симметрии двойной связи, применяют префикс (Е)-. E, Z-Система позволяет однозначно указывать расположение заместителей у С=С, так как цис- и транс- применимы не во всех случаях. В двух последних случаях обозначение префиксами цис- и транс- неприемлемо:

|
|