
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Агрегативная устойчивость коллоидных растворов. Коагуляция
|
|
Агрегатпивная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т. е. размеры частиц и их индивидуальность.
При нарушении агрегативной устойчивости происходит коагуляция.
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седименгационной устойчивости.
2 стадия – явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое-либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
К таким воздействиям относятся:
• изменение температуры; в действие электрического и электромагнитного полей; действие видимого света;
• облучение элементарными частицами;
• механическое воздействие;
• добавление электролитов и др.
Все эти воздействия, различные по характеру, обладают общим свойством – они уничтожают энергетический барьер (потенциальный барьер коагуляции  UK) или значительно его снижают, и метастабильная система – коллоидный раствор в процессе коагуляции переходит в более устойчивое состояние.
UK) или значительно его снижают, и метастабильная система – коллоидный раствор в процессе коагуляции переходит в более устойчивое состояние.
Наибольший практический интерес вызывает коагуляция электролитами.
ПРАВИЛА КОАГУЛЯЦИИ
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минцмальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ск.
Иногда вместо порога коагуляции используют величину Vk, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:

Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом – коагулянтом.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона.
Количественно эта закономерность описывается эмпирическим правилом Шулъце-Гарди,
 или
или 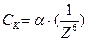
где  – постоянная для данной системы величина; Z – заряд иона-коагулянта;
– постоянная для данной системы величина; Z – заряд иона-коагулянта;  – порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.
– порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Поэтому коагулирующая способность органических ионов больше по сравнению с неорганическими ионами.
Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
Этот ряд называется лиотропным.
При увеличении концентрации иона-коагулянта дзета-потенциал мицеллы золя уменьшается по абсолютной величине. Коагуляция может начинаться уже тогда, когда дзета – потенциал снижается до 0, 025 – 0, 040 В (а не до нуля).
|
|