
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Физические свойства кетонов.
|
|
Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства альдегидов:
1. Реакции окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:

Ароматические альдегиды окисляются труднее алифатических. Кетоны, как было сказано выше, окисляются труднее альдегидов. Окисление кетонов проводится в жестких условиях, в присутствии сильных окислителей. Образуются в результате смеси карбоновых кислот. Как отличить альдегиды от кетонов? Различие в способности к окислению служит основой качественных реакций, позволяющих отличить альдегиды от кетонов. Многие мягкие окислители легко реагируют с альдегидами, но инертны по отношению к кетонам. а) Реактив Толленса (аммиачный раствор оксида серебра), содержащий комплексные ионы [Ag(NH3)2]+, дает с альдегидами реакцию «серебряного зеркала». При этом образуется металлическое серебро. Раствор оксида серебра готовят непосредственно перед опытом:

Реактив Толленса окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, который образуется при этой реакции, реакция альдегидов с аммиачным раствором оксида серебра получила название реакции «серебряного зеркала».

Альдегиды также восстанавливают свежеприготовленный аммиачный раствор гидроксида меди (II), обладающий светло-голубой окраской (реактив Фелинга), до желтого гидроксида меди (I), который при нагревании разлагается с выделением ярко-красного осадка оксида меди (I).

2. Реакции присоединения
Гидрирование - присоединение водорода.
Карбонильные соединения восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем гидрирование алкенов: требуется нагревание, высокое давление и металлический катализатор (Pt, Ni): 
3. Взаимодействие с водой.

4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
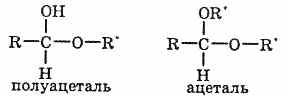
Ацетали, в отличие от альдегидов, более устойчивы к окислению. Благодаря обратимости взаимодействия со спиртами их часто используют в органическом синтезе для «защиты» альдегидной группы.
5.Присоединение гидросульфитов.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.


В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Фрагмент фенолформальдегидной смолы показан ниже: 
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Химические свойства кетонов:
1)

2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:

2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:

3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:

|
|