
Главная страница
Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
|
Обязанности работника в области охраны труда.
ОТ – это система сохранения жизни и здоровья работников в процессе трудовой деятельности, включающая в себя правовые, социально-экономические, организационно-технические, санитарно-гигиенические, лечебно-профилактические, реабилитационные и иные мероприятия.
Ст.214 ТК РФ обязанности работника в области ОТ:
1. Соблюдать требования ОТ.
2. Правильно применять средства индивидуальной и коллективной защиты.
3. Проходить обучение безопасности методам и приёмам выполнения работ, оказание пер.помощи пострадавшим на производстве, инструктаж по ОТ, стажировка на раб.месте, проверку знаний треб-й ОТ.
4. Немедленно извещать своего непосред-го или вышестоящего рук-ля о любой ситуации, угрож-ий жизни и здоровью людей, о каждом Н.С. произошедшим на производстве или об ухудшении состоянии своего здоровья, в т.ч. о проявлении признаков острого проф.заб-ия (отравление).
5. Проходить обяз-ую, предварительные (при поступлении на работу и периодические мед.осмотры).
|
Билет №17
1. Оксиды. Классификация, номенклатура, физические и химические свойства.
Оксиды – это сложные вещества состоящие из 2-х элементов в один из которых кислород.(например: CaO, Fe2O3, SO2 и т.д.).
Оксиды делятся на основные, кислотные и амфотерные.
Основные – это те оксиды, которые при взаимодействии с водой образуют основания.
Na2O+H2O → 2NaOH
Кислотные – это оксиды которые при взаимодействии с водой образуют кислоты.
SO3+H2O → H2SO4
Амфотерные – это оксиды которые проявляют и основные, и кислотные свойства в зависимости от условий.
Получение:
1 Горение простых и сложных веществ
C+O2 → CO2
CH4+O2 → CO2+2H2
2 При разложение солей гидроксидов
CaCO3 → CaO+CO2
2Fe(OH)3 → Fe2O3+3H2O
2. Основные понятия метрологии химического анализа (правильность, сходимость, воспроизводимость, точность, пределы обнаружения).
Метрология – наука об измерениях и методах достижения их единства и требуемой точности. Один из основных разделов метрологии посвящен методам определения погрешности измерений и созданию эталонов.
Метрологическими характеристиками методик анализа помимо погрешности являются правильность, воспроизводимость, точность, а при определении микроконцентрации также предел обнаружения.
Правильностью измерений называют качество измерений отражающее близость к нулю систематических погрешностей.
Сходимостью измерений называют качество измерений, выполняемых в одинаковых условиях.
Воспроизводимостью измерений называют качество измерений, отражающее близость друг к другу результатов измерений, выполняемых в различных условиях (в разное время, разные методы..)
Точностью измерений называют качество измерений, отражающее близость их результатов к истинному значению измеряемой величины.
3. Количественный анализ. Методы расчета хроматограмм
Хроматографический метод – относительный метод анализа. Измеряемая концентрация на выходе сильно отличается от концентрации в анализируемой пробе. При вводе пробы в колонку она сразу же разбавляется в детекторе газом-носителем, при прохождении пробы через колонку происходит дополнительное размывание в результате на выходе концентрация компонентов совсем другая. Для проведения количественного анализа необходима градуировка – установление связи между первоначальными концентрациями в пробе и сигналами, полученными на выходе из колонки. Хроматограф – определяется как индивидуально градуируемая система.
Метод абсолютной градуировки. Метод заключается в построении графика зависимости площади или высоты пика от содержания соединения в пробе. При выполнении количественного анализа по методу абсолютной градуировки предъявляется высокие требования к точности и воспроизводимости дозирования пробы. Кроме того необходимо строго соблюдать тождественность условий при градуировке прибора и при реальных анализах. Наиболее воспроизводимое дозирование выполняется газовым краном-дозатором или специальными дозаторами жидкости.
Метод внутреннего стандарта. В методе внутреннего стандарта к известному количеству анализируемого образца добавляется известное количество не содержащегося в нём эталонного соединения – внутреннего стандарта.
Недостатки метода внутреннего стандарта:
трудности при выборе внутреннего стандарта в некоторых случаях;
необходимость подготовки пробы – добавка стандарта и возможное введение дополнительной погрешности.
Метод внутренней стандартизации. В методе внутренней нормализации процентное отношение анализируемого соединения в пробе определяют отношением его площади к сумме площадей всех компонентов на хроматограмме. В этом методе необходимо измерять количественные параметры всех пиков и приводить с помощью поправочных коэффициентов к единой шкале чувствительности детектирования.
Параметры хроматографического пика
Выходной сигнал анализируемого соединения имеет форму треугольника или пика, это обычно участок нулевой линии, на котором возникает сигнал при выходе анализируемого соединения из хроматографической колонки. Нулевая или базовая линия – это участок, соответствующий нулевой концентрации анализируемого соединения. Запись пика исследуемого соединения вместе с участками нулевой линии до и после пика называется хроматограммой. Высота пика – это расстояние от максимума пика до его основания, измеренное параллельно оси отклика детектора. Ширина пика у основания – это отрезок основания пика, отсекаемый двумя касательными, проведёнными в точках перегибов восходящей и нисходящей ветвей хроматографического пика. Ширина пика на полувысоте – это отсекаемый пиком отрезок линии, проведённой параллельно основанию пика на середине его высоты. Площадь пика – это площадь части хроматограммы, заключённой между пиком и его основанием.
Важным параметром пика является коэффициент асимметрии, который применяется для сравнения различных твёрдых носителей, адсорбентов и всей газовой системы хроматографа в целом. В идеальных условиях пик симметричен. На практике пики по разным причинам в основном несимметричны.
Асимметрия пиков ухудшает разделение и затрудняет количественную обработку.
Асимметричные пики появляются при разделении на неоднородных сорбентах. Асимметрию пиков оценивают относительно полуширин пиков на половине высоты (рис.1.2) отношением отрезка БВ к АБ, либо отношением отрезков ДЕ к ГД на 1/10 высоты пика от основания. Точнее пользоваться отношением площадей половин пика – отношением заштрихованной части пика к не заштрихованной
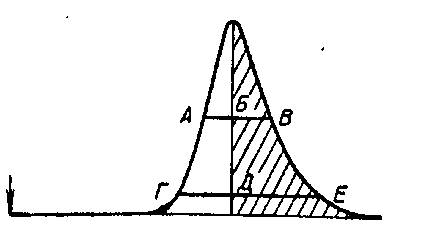 4. Действие электрического тока на организм человека, защита от воздействия электрического тока.
Электробезопасность –это система организационных и технических мероприятий и средств, обеспечивающих защиту людей от вредного и опасного воздействия эл.тока, эл.дуги, эл.-магн.поля, стат.эл-ва.
Факторы опасного и вредного воздействия на человека:
Протекание эл.тока через организм человека, воздействие эл.дуги, воздействие эл.стат.поля, эл.-магн.излучения.
Опасные и вредные последствия для человека проявл-ся в виде эл.травм (металлизация кожи, эл.знаки и ожоги, электроофтальмия, резкое сокращение мышц, фибрилляция сердца, элекролиз крови) механических повреждений и проф.заболеваний.
Степень воздействия зависит от:
-рода и величины напряжения и тока
-частоты эл.тока
-путей тока через тело человека
-продолжительности воздействия эл.тока
-условий внешней среды.
Меры защиты:
- защитное заземление
- зануление
- защитное отключение
- применение низких напряжений (12, 36, 42 Вт)
- двойная изоляция
- ограждение неизолированных токоведущих частей и расположение их на недоступной высоте.
4. Действие электрического тока на организм человека, защита от воздействия электрического тока.
Электробезопасность –это система организационных и технических мероприятий и средств, обеспечивающих защиту людей от вредного и опасного воздействия эл.тока, эл.дуги, эл.-магн.поля, стат.эл-ва.
Факторы опасного и вредного воздействия на человека:
Протекание эл.тока через организм человека, воздействие эл.дуги, воздействие эл.стат.поля, эл.-магн.излучения.
Опасные и вредные последствия для человека проявл-ся в виде эл.травм (металлизация кожи, эл.знаки и ожоги, электроофтальмия, резкое сокращение мышц, фибрилляция сердца, элекролиз крови) механических повреждений и проф.заболеваний.
Степень воздействия зависит от:
-рода и величины напряжения и тока
-частоты эл.тока
-путей тока через тело человека
-продолжительности воздействия эл.тока
-условий внешней среды.
Меры защиты:
- защитное заземление
- зануление
- защитное отключение
- применение низких напряжений (12, 36, 42 Вт)
- двойная изоляция
- ограждение неизолированных токоведущих частей и расположение их на недоступной высоте.
|
| Билет №18
1. Основания. Классификация, номенклатура. Физические и химические свойства.
Общая формула основания Me(OH)n (NaOH, KOH, Ba(OH)2)
Гидроксиды – это вещества состоящие из атома Ме и одной или несколько гидроксильных групп.
По растворимости в воде делятся на растворимые и нерастворимые.
Растворимые в воде основания называются щелочь (гидроксиды щелочных и щелочно-земельных металлов)
Щелочи реагируя с кислотами (реакции нейтрализации)
NaOH+HCl → NaCl+H2O
В растворах щелочей лакмус окрашивается в синий, метилоранж – в желтый и фенофталеин в малиновый.
Все не растворимые в воде основания, а также NH4OH являются слабыми основаниями, диссоциируют обратимо.
NH4OH ↔ NH4+ + OH-
Получение:
1. Взаимодействие солей с гидроксидами
Na2SO4+Ba(OH)2 → 2NaOH+BaSO4↓
2. Растворимые основания можно получить взаимодейстием Ме или оксидов Ме с водой
1) 2Na+4H2O → NaOH+H2↑
2) Na2O+H2O → 2NaOH
2. Растворы. Классификация растворов. Понятие о растворимости веществ.
Растворы – это гомогенные (однородные) системы, состоящие из двух или нескольких компонентов, относительные количества которых могут изменяться в определенных пределах.
Гомогенность растворов означает, что структурные частицы всех компонентов (молекулы, атомы, ионы) равномерно распределены по всему объему раствора; отсутствуют поверхности разделов между компонентами.
К растворам можно отнести любую смесь газов (воздух смесь О2, N2…)
К растворам относятся сплавы некоторых металлов, в кот. атомы этих металлов равномерно по всему объему сплава. Это так называемые твердые растворы.
Однако наибольшее значение имеют жидкие растворы, образующиеся при растворении в жидком компоненте (растворителе) других компонентов (твердых, жидких, газообразных веществ), которые называются растворенными веществами.
Наиболее распространенным растворителем является вода, поэтому среди жидких растворов уникальную роль играют водные растворы.
Важной характеристикой вещества является его растворимость.
Растворимость – способность вещества растворяться в воде или другом растворителе.
При растворении веществ могут образоваться насыщенные, ненасыщенные и пересыщенные растворы.
Насыщенный раствор содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор содержит меньше растворяемого вещества, чем насыщенный раствор при данной температуре.
Пересыщенные растворы – содержание растворяемых веществ больше, чем насыщенный раствор при данной температуре. Они не устойчивы.
Количественной характеристикой растворимости вещества в воде является коэффициент растворимости Р, который показывает, какая максимальная масса вещества может раствориться в 100г воды с образованием насыщенного при данной температуре раствора.
Растворимость одного и того же вещества в разных растворителях различна.
Растворимость данного вещества в данном растворителе зависит от внешних факторов.
Для твердых веществ главный фактор- температура. Растворимость с ростом темп. увеличивается.
Растворимость газов с повышением температуры уменьшается.
3. Титриметрический анализ (титрование, точка эквивалентности, точка конца титрования). Основные методы титриметрического анализа
Титрование – это постепенное прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности (т.э.). Ее замечают по изменению индикатора – специального вспомогательного вещества, которое вводят в титруемый раствор (внутренний индикатор). В области т.э. индикатор изменяет свой цвет, образует осадок. Момент титрования, когда наблюдается изменение индикатора, называется точкой конца титрования (т.к.т.). В идеальном случае т.э. и т.к.т. совпадают, однако в практических условиях между ними наблюдается некоторая разница. Чем больше эта разница, тем больше погрешность титрования. Поэтому следует подбирать такой индикатор, чтобы разность между т.э. и т.к.т. была минимальной
При классификации по типу основной реакции, протекающей при титровании, выделяют следующие методы титриметрического анализа
1. Методы кислотно-основного взаимодействия связаны с процессом передачи протона:
H++OH- = H2O
СН3СООН + ОН- = СН3СОО- + Н2О
СО32- + Н+ = НСО3
2. Методы комплексообразования основаны на реакциях образования координационных соединений:
Hg2+ + 2CI- = HgCI2 (меркуриметрия)
Mg2++ H2Y2- = MgY2- + 2H+ (комплексонометрия)
3. Методы осаждения основаны на реакциях образования малорастворимых соедине-ний:
Аg2+ + 2CI- = АgCI2 (аргентометрия)
Нg2 2++ 2CI- = Нg2 CI2 (мекурометрия)
4. Методы окисления-восстановления объединяют многочисленную группу о-в реак-ции:
MnO4- +5Fe2+ + 8H+ =Mn2+ + 5Fe2+ + 4H2O (перманганатометрия)
2S2O32- + J2 = S4O62- +2J- (иодометрия)
Аналитическая характеристика каждого метода включает наиболее существенные его особенности: приготовление и св-ва рабочих растворов, виды кривых титрования, погрешности определения, способы индикации точки эквивалентности и практическое применение.
4. Правила техники безопасности при работе в лаборатории с химической посудой.
|
| Билет №19
1. Кислоты. Классификация, номенклатура. Химические свойства.
Это сложные вещества молекулы которых состоят из атомов H и кислотного остатка.
В зависимости от количества атомов H, кислоты бывают одно- (HCl, HNO3), двух- (H2SO4, H2CO3) и трехосновные (H3PO4).
Если в молекуле кислоты присутствует атом кислорода, то кислородосодержащая кислота, если кислород отсутствует – бескислородная кислота.
Неорганические кислоты называются еще минеральными кислотами, по физическим свойствам: соляная кислота – бесцветная жидкость, с едким запахом.(концентрированная соляная кислота содержит 37%.
Серная кислота бесцветная маслянистая жидкость, почти в 2 раза тяжелее воды.
Азотная кислота – бесцветная жидкость в 1, 5 раза тяжелее воды.
Получение:
1) SO3 + H2O↔ H2SO4
2) Na2SiO3 + H2SO4 ↔ Na2SO4 + H2SiO3↓
Бескислородные кислоты получают синтезом Н с последующим растворением в воде.
2. Ионное произведение воды. Понятие о водородном показателе.
Произведение концентрации ионов водорода и гидроксид ионов в воде при 25⁰ С является величиной постоянной и равной 10-14. Эта величина называется ионным произведением воды и обозначается символом КН2О = Н+. ОН- = 10-14
Как бы не изменялись концентрации ионов водорода и гидроксид ионов, произведение их концентрации, т.е ионное произведение воды, остается величиной постоянной.
При растворении в воде тех или иных электролитов образуются растворы, различающиеся характером среды. Существует 3 типа сред водных растворов: нейтральная, кислая, щелочная.
Среда водного раствора, в которой концентрация ионов водорода Н+, равна концентрации гидроксид ионов ОН-, называется нейтральной средой.
Концентрация ионов водорода Н+ больше- кислая среда
Концентрации гидроксид ионов ОН-больше – щелочная среда
Водородный показатель (рН) – величина, характеризующая концентрацию ионов водорода в растворе, численно равная отрицательному десятичному логорифму концентрации ионов водорода: рН= -lg(Н+).
Водные растворы могут иметь величину рН в интервале от 0 до 14. В нейтральных растворах рН=7. При добавлении в р-р кислоты рН меньше 7, при добавлении щелочи больше 7.
3. Сущность кислотно-основного титрования, рабочие растворы, индикаторы.
Рассмотрение каждого титриметрического метода включает наиболее существенные его особенности: химическое уравнение реакции титрования, приготовление и свойства рабочих растворов, виды кривых титрования, способы индикации точки эквивалентности, погрешность определения и практическое применение.
В методах кислотно-основного титрования основой является реакция передачи протона от титранта титруемому веществу или наоборот. Реакции кислотно-основного взаимодействия характеризуются высокой скоростью, протекают строго стехиометрически.
В качестве рабочего раствора используются растворы сильных кислот (соляная, серная) концентрации от 0, 05 до 1, 0 моль/л или сильных оснований (NaOH, KOH), той же концентрации.
Точную концентрацию титрованных растворов кислот и щелочей устанавливают по одному из первичных стандартных (установочных) в-в. Для стандартизации кислоты часто используют карбонат натрия Na2CO3 (сода).
Для стандартизации щелочи используют гидрофталат калия или бензойная кислота С6Н5СООН.
Для обнаружения точки эквивалентности в титриметрическом анализе применяют индикаторы. Наиболее распространены цветные индикаторы, окраска которых зависит от рН р-ра. (из растительных экстрактов – куркума, лакмус; синтетические индикаторы – фенолфталеин)
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута или не достигнута точка эквивалентности.
Правильно выбранный индикатор изменяет окраску в области скачка титрования. Резкое изменение цвета индикатора при добавлении лишь одной капли титранта связано с резким, в несколько единиц, изменением рН в области скачка титрования.
4. Обязанности работника в области охраны труда. Виды ответственности.
ОТ – это система сохранения жизни и здоровья работников в процессе трудовой деятельности, включающая в себя правовые, социально-экономические, организационно-технические, санитарно-гигиенические, лечебно-профилактические, реабилитационные и иные мероприятия.
Ст.214 ТК РФ обязанности работника в области ОТ:
1. Соблюдать требования ОТ.
2. Правильно применять средства индивидуальной и коллективной защиты.
3. Проходить обучение безопасности методам и приёмам выполнения работ, оказание пер.помощи пострадавшим на производстве, инструктаж по ОТ, стажировка на раб.месте, проверку знаний треб-й ОТ.
4. Немедленно извещать своего непосред-го или вышестоящего рук-ля о любой ситуации, угрож-ий жизни и здоровью людей, о каждом Н.С. произошедшим на производстве или об ухудшении состоянии своего здоровья, в т.ч. о проявлении признаков острого проф.заб-ия (отравление).
5.Проходить обяз-ую, предварительные (при поступлении на работу и периодические мед.осмотры).
Виды ответственности.
За нарушение труд.закон-ва и иных актов содер-их нормы труд.права предусм-ся след.виды ответст-ти:
- дисциплинарное (замечание, выговор, увольнение по соответствующим основаниям);
- административное (предупреждение письменное, адм-ый штраф, дисквалификация, адм-ое приостановление деят-ти и т.д.);
- уголовная – предусматривает ст.143 УК РФ;
- материальная.
|
| Билет №20
1. Соли. Классификация. Способы получения. Реакции ионного обмена.
Это сложные вещества в состав молекул которых входят атомы Ме связанные с кислотными остатками.
Если в молекуле кислоты все атомы Н, замещены атомами Ме, то такая соль называется средней (Na2CO3, K2SO4)
Если атомы Н не полностью замещены на атомы Ме, то это кислая соль (NaHCO3(бикарбонат натрия), KHSO4 (бисульфат К).
Получение:
1) 2K+Cl2 → 2KCl
2) Ca(OH)2+CO2→ CaCO3+H2O
3) H2SO4+Cu(OH)2→ CuSO4+2H2O
4) H2SO4+CuO→ CuSO4+H2O
5) Na2SO4+BaCl → BaSO4↓ +2NaCl
2. Индикаторы. Основные типы индикаторов. Основные показатели индикаторов.
Индикаторами называют вещества, применяемые при объемно-аналитических определениях и в некоторых других случаях для определения конца реакции.
Момент окончания реакции определяют или по изменению окраски (н-р метилоранж) или же по исчезновению или появлению ее (н-р фенолфталеина).
Применять один и тот же индикатор во всех случаях титрования нельзя, это может привести к ошибкам. Индикаторы обычно готовят в виде разбавленных водных, спирто-водных или спиртовых растворов.
Изменение окраски индикатора зависит от изменения концентрации ионов водорода (рН), причем каждый индикатор меняет окраску только в определенных интервалах рН.
Для обнаружения точки эквивалентности в титриметрическом анализе применяют индикаторы. Наиболее распространены цветные индикаторы, окраска которых зависит от рН р-ра. (из растительных экстрактов – куркума, лакмус; синтетические индикаторы – фенолфталеин)
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута или не достигнута точка эквивалентности.
Правильно выбранный индикатор изменяет окраску в области скачка титрования. Резкое изменение цвета индикатора при добавлении лишь одной капли титранта связано с резким, в несколько единиц, изменением рН в области скачка титрования.
3. Гравиметрический анализ. Основные операции метода осаждения.
Гравиметрический анализ основан на определении массы вещества. В ходе гравиметрического анализа определяемое вещество или отгоняется в виде какого-либо летучего соединения (метод отгонки) или осаждается из раствора в виде малорастворимого соединения (метод осаждения).
Методом отгонки определяют например содержание кристаллизационной воды в кристаллогидратах, если вещество при нагревании не претерпевает других химических изменений, кроме выделения воды.
Метод отгонки применяют также при анализе карбонатов, некоторых нитратов образующие летучие продукты реакции.
Содержание анализируемого компонента определяют по уменьшению массы вещества, в результате термической обработки или по увеличению массы поглотителя газообразных продуктов реакции.
Методы осаждения применяются наиболее широко и их методы отгонки
В след за растворением пробы выполняются следующие операции:
1. Осаждение
2. Фильтрование и промывание осадка
3. Высушивание или прокаливание осадка
4. Взвешивание
5. Расчет
Осаждение.
Соединение в виде которого осаждается из раствора называется формой осаждения.
Например при осаждении сульфата формой осаждения является BaSO4, при осаждении Fe 3-х валентного соответствующий гидроксид Fe(OH)3
В качестве формы осаждения в гравиметрическом анализе можно использовать далеко не любой осадок.
К форме осаждения предъявляются следующие основные требования:
1. Осадок должен быть малорастворим, т.е. осаждение должно быть достаточно полным.
2. Полученный осадок должен быть чистым и легко фильтрующимся.
Необходимо также, чтобы из формы осаждения легко получалась гравиметрическая форма.
В полной мере из требований ни один из осадков неудовлетворяет, но можно предусмотреть и создать такие условия осаждения при которых предъявляемые требования будут удовлетворены в максимально возможной степени.
Решающее влияние на полноту зрения и свойства осадка оказывают следующие условия:
1. концентрация (количество осадителя)
2. температура
3. концентрация посторонних солей
Полнота осаждения.
Для достижения полноты осаждения необходим избыток осадителя и не желательно посторонние электролиты, вызывающие уменьшение коэффициента активности и как следствие возрастания растворимости осадка.
Однако чрезмерно большой избыток осадителя нежелателен, т.к. это может привести к частичному растворению осадка за счет комплексообразования и солевого эффекта,
Также избыток осадителя увеличивает загрязнение осадка в следствии соосождения.
Чистота осадков
Образование не загрязнённых крупнокристаллических осадков является необходимым условием получения точных результатов в гравиметрическом анализе.
Крупнокристаллические осадки получаются более чистыми, чем микрокристаллические или аморфные, т.к. имеют менее развитую поверхность и поэтому адсорбируют меньше примесей.
Крупнокристаллические осадки легко фильтруются, мелкокристаллические могут забивать поры фильтра и тогда скорость фильтрования падает практически до 0, таким образом для получения чистых легко фильтрующихся осадков необходимо предусмотреть условия осаждения при которой образуются крупные кристаллы.
Образование осадка начинается с формирования зародышей или центров кристаллизации мельчайших образований по размерам.
Рост этих образований в результате приводит к появлению более крупных частиц, которые и выпадают в осадок, таким образом на размер кристаллов оказывает влияние относительные скорости 2-х основных процессов:
1. Скорость образования центров кристаллизации.
2. Скорость роста кристаллов.
4. Фильтрующие противогазы. Правила хранения и обращения с ними
Ф.П. применяют при содержании свободного О2 в воздухе не менее 18% об. и суммарное содержание парогазообразных примесей 0, 5% об.
Разл.промыш-е фильтр-ие противогазы малого габарита, среднего габарита и модульные.
Промышленные фильтрующие противогазы состоит из:
-шлем-маски (панорамной маски),
-гофрированной маски (за исключением против. малого габарита)
-фильтра с поглотителями
-сумки для противогаза
К комплекту противогаза прикладывается памятка по применению и паспорт.
|
| Билет №21
1. Ароматические углеводороды. Свойства бензола
Ароматические углеводороды – это большой класс органических соединений молекула которых содержит один или несколько циклов из шести атомов углерода с чередующимися одинарными и двойными связями.
Простейшим ароматическим углеводородом является бензол (С6Н6)
Углеводороды бензольного ряда имеют общее название – арены.
Химические свойства
Ароматичность определяет ароматические свойства бензола. Шести электронная π система является более устойчивой, чем обычная 2-х электронная π связь, поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для предельных углеводородов.
Наиболее характерные для реакции замещения, т.о. ароматические углеводороды по своим химическим свойствам занимают промежуточные положения между предельными и непредельными.
1. Реакции замещения (галогенирование)
2. Реакции присоединения
- гидрирование
- хлорирование
3. Реакции окисления
2. Способы выражения концентрации растворов. Эквивалент. Эквивалент соли, основания кислоты, простого вещества
Для качественной характеристики состава растворов используют понятия разбавленный раствор и концентрированный раствор.
Разбавленный раствор содержит малое количество растворенного вещества и большое кол-во растворителя.
Концентрированный раствор содержит большое количество растворенного вещества и небольшое кол-во растворителя.
Необходимо различать понятия «концентрированный раствор» и «насыщенный» раствор. Если в-во хорошо растворяется в воде, то его концентрированный водный раствор может быть ненасыщенным.
Для выражения количественного состава растворов используются различные способы:
1) Массовая доля растворенного вещества
2) Молярная концентрация.
Массовая доля растворенного вещества ω (р.в) равна отношению массы растворенного вещества m (р.в) к массе раствора m (р-р)
ω (р.в) = m (р.в) / m (р-р)
Массовая доля растворенного вещества в процентах (процентная концентрация) равна ω (р.в) = m (р.в) / m (р-р) * 100%
Если даны объем и плотность раствора, то массу раствора рассчитывают по формулеm (р-р) = V (р-р) *ρ (р-р)
Эквивалентом называютреальную или условную частицу вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода.
Молярност ь – концентрация раствора, выраженная в молях, содержащихся в одном литре раствора (раствор содержащий в 1л 1 моль называется одномолярным) моль серной кислоты = 98, 08г, одномолярный раствор должен содержать это кол-вов 1л раствора.
Нормальность - концентрация раствора, выраженная числом грамм-эквивалентов, содержащихся в 1 л раствора
Эквивалент кислоты = Молекулярная масса кислоты / на кол-во атомов Н
Эквивалент основания = Молекулярная масса основания / на кол-во гидроксильной группы.
Эквивалент соли = Молекулярная масса соли / на кол-во кислотного остатка.
3. Детектор по теплопроводности
Чувствительными элементами в ДТП являются нагретые нити (филаменты) из специальных металлов (платина, вольфрам, вольфрам-рений и др.), помещенные в специальные камеры, продуваемые газом – носителем. Филаменты включены в плечи моста Уинстона через сравнительную камеру проходит поток чистого газа-носителя, через рабочую камеру газ-носитель с примесями разделяемых соединений. Сопротивление нитей зависит от температуры. При изменении состава газа в рабочей камере теплопроводность его изменяется, изменяется теплопередача от нити к стенкам камеры и изменяется температура нити и, следовательно, сопротивление нити по сравнению с сопротивлением нити в сравнительной камере. Происходит разбаланс моста, возникает сигнал на нулевой линии.
4. Виды вентиляции, назначение.
Вентиляция – это совокупность мероприятий и устройств необх. для обеспечения заданного количества возд.среды в рабочих помещениях.
По способу перемещения воздуха вентиляция может быть естественная и механическая.
По форме организации воздухообмена вентиляция может быть местная и общеобменная.
Типы вентиляционные установок:
· Вытяжные – предназначены для удаления воздуха (бывают: местные и общие)
· Приточные – осуществляют подачу воздуха (бывают: местные – возд.души, завесы, оазисы; и общие – рассеянный или сосредоточенный приток воздуха.
|
Билет №22
1. Алкены. Изомерия, номенклатура. Химические свойства.
Алкены (не предельные, ненасыщенные)– это УВ нециклического строения, в молекулах которых все атомы «С» находятся в состоянии sp2- гибридизации и связаны друг с другом только σ -связями. Общая фомула алканов: СnH2n. (n ≥ 2) Гомологический ряд (этилен, пропилен,...
Изомерия и номенклатура
А) изомерия цепи Б) изомерия положения двойных связей В) цис-, транс-изомерия
Физические св-ва С2-С4 –газы, С5-С16 –жидкости, С17… -твердые в-ва
Химические свойства
Химически свойства определяется наличием двойной связи. Наиболее характерны р-ии присоед-я:
1 Присоединения
1)Галогенирование СН2=СН2 + Сl2→ Сl-СН2-СН2-Сl - дихлорэтан
2)гидрирование СН2=СН- СН3 +Н2 → СН3-СН2-СН3 - пропан
3)гидрогалогенирование СН2=СН2 +НСl → СН3-СН2-Сl -хлорэтан
4)Гидратация СН2-СН2 +НОН → СН3-СН2-ОН - этанол
2 Реакции окисления
Полное окисление (горение)
С2Н4 + 3О2 → 2СО2 + 2Н2О
3 Реакция полимеризации
2. Аналитические реакции. Требования, предъявляемые к аналитическим реакциям
Аналитические реакции должны быть:
Характерными, т.е. присущими только анализируемому компоненту.
Достаточно интенсивными. Чем выше интенсивность св-ва, тем меньшее кол-во компонента можно анализировать, т.е. тем чувствительнее метод.
Неизменными (устойчивыми) по своим параметрам при изменении в определенном диапазоне условии анализа.
Однозначно связанными с природой и составом анализируемого компонента.
В кислотно-основных реакциях измеряется рН и фиксируется изменение цвета индикатора; о-в реакциях изменяется электродный потенциал, фиксируется появление (перманганатометрия) или исчезновение (иодометрия) цвета в результате появления избытка одного из участков реакции.
Реакции, в которых достигаются указанные эффекты, принято называть аналитическими реакциями.
Они отличаются практически необратимым характером и высокой скоростью протекания, а также стехиометричностью. Желательно, чтобы они были избирательными и чувствительными.
3. Пламенно ионизационный детектор (ПИД)
основан на ионизации органических соединений в пламени водорода. Точный механизм ионизации пока еще не выяснен. С использованием масспектрометрометра проведено исследование и обнаружено, что механизм ионообразования связан с термодекструкцией с последующей хемиионизацией.
В ПИД одним из электродов служит горелка, второй электрод – коллектор располагается над горелкой. Малые токи (1.10-9 –10-12А) усиливаются, т.к. шумы самого детектора малы. Из-за высокой чувствительности, большого диапазона линейности ПИД стал наиболее распространенным детектором.
 4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
|
| Билет №23
1. Алкадиены. Изомерия, номенклатура. Химические свойства.
Диеновые УВ –это УВ, в молекулах которых между атомами углерода имеются две двойные связи. Общая фомула алканов: СnH2n-2 (n ≥ 3)
В зависимости от взаимного распол. дв. связей в молекулах алкадиены делятся на 3 типа:
1) Диены с кумулированными связями (две двойные связи у одного атома углерода)
2) С сопряженными связями (две двойные связи разделены одной одинарной связью
3) С изолированными связями (двойные связи разделены более, чем одной одинарной связью.
Химические свойства
Наиболее характерны реакции присоединения:
1 Присоединения
1) Галогенирование СН2=СН-СН=СН2+ Br2→ Br-СН2-СН=СН-СН2-Br
2) Гидрирование СН2=СН- СН=СН2 +2Н2 → СН3-СН2-СН2-СН3 (в 2 стадии)
3) Гидрогалогенирование СН2=СН-СН=СН2+ НBr→ СН3-СН=СН-СН2-Br
2 Реакция полимеризации
2. Химическое равновесие. Понятие о гидролизе
Если при протекании химических реакций исходные вещества более или менее быстро превращаются в продукты реакции и не происходит обратного превращения этих продуктов в исходные вещества, о такой реакции говорят, что она идет в одном направлении и ее называют необратимой реакцией.
Необратимая реакция завершается когда полностью израсходуются все исходные вещества (если они были взяты в количествах необходимых для реакции или хотя бы одно из исходных веществ, если остальные вещества взяты в избыточном количестве.
В уравнениях необратимых реакциях между левой и правой частямизаписывается = или →.
Необратимыми являются:
а) реакции сопровождающиеся большим количеством выделения теплоты (горение)
б) реакции разложения некоторых веществ в ходе которых один из продуктов уходит из сферы реакции осадка или газа.
Большинство реакций являются обратимыми.
Обратимыми называются реакции которые одновременно протекают и в прямом и в обратном направлении.
В уравнениях обратимых реакций между левыми и правыми частями записываются ↔.
Любая обратимая реакция достигает состояния химического равновесия.
Химическое равновесие – это состояние обратимой реакции характеризующиеся равенством скоростей, прямой и обратной реакций.
Примером обратной реакцией является синтез HJ из J и H.
H2+J2↔ 2HJ
H и J соединяясь друг с другом образуяHJ который способен обратно разлагается на H и J.
Химическое равновесие является динамическим поскольку и прямая, и обратная продолжает протекать, однако концентрация всех веществ реакционной равновесной системы сохраняется постоянным, эти концентрации называются равновесными.
3. Качественный анализ хроматографирования
Аналитические задачи в газовой хроматографии можно разделить на два типа:
- анализ смесей, качественный состав которых заранее известен, это в основном технологические задачи в химической, нефтехимической промышленности и др. областях;
анализ смесей, качественный состав которых не известен; такие задачи встречаются в контроле загрязнений окружающей среды, в биохимии, медицине, санитарной и судебной химии и др. областях.
Во втором случае перед проведением количественного анализа необходимо провести идентификацию неизвестных компонентов смеси.
Выделяют следующие методы идентификации, применяемые в газовой хроматографии:
методы, основанные на применении параметров удерживания;
методы с использованием химических реакций до хроматографических колонок;
методы с использованием качественных химических реакций на выходе из колонки;
методы с использованием специальных детектирующих систем;
методы, основанные на сборе разделенных компонентов в чистом виде и применении других физико-химических методов;
методы, основанные на селективном удалении (поглощении) некоторых разделенных компонентов смеси;
методы, основанные на сочетании параметров удерживания и масспектрометрии;
методы на основе корреляционных зависимостей параметров
удерживания.
Для качественного анализа применяются корреляционные зависимости параметров удерживания от числа атомов углерода в молекуле, температур кипения, электронных поляризуемостей исследованных соединений.
4. Правила техники безопасности в лаборатории с химической посудой.
|
Билет №24
1. Свойства гомологов бензола, реакции с участием боковой цепи, реакции с участием бензольного ядра.
Молекула гомологов бензола имеет место взаимное влияние алькильного радикала находящегося в боковой цепи бензольного ядра.
В молекулах представляющих собой сопряженные системы проявляется действие эффекта который называется мезомерным эффектом сопряжения, он передается по сопряженной системе π -связи и обозначается буквой М.
Равномерное распределение электронной плотности в молекуле бензола нарушается, если в бензольное ядро вводится какой-нибудь заместитель. Делится на 2 группы в зависимости от проявляемыми ими мезамерного эффекта:
1. электронно-донорные заместители. Проявляют +М эффект и повышают электронную плотность в сопряженной системе.
При этом она сосредотачивается в орто- и параположениях.
К электроно-донорным заместителям относятся алкильные радикалы (CH3), группы OH, NH2 галогены Cl, Br.
В присутствии этих заместителей в бензольном ядре облегчает замещение атомов водорода в орто- и параположениях, т.е. они напрвляют новые заместители именно в эти положения и поэтому называются орто- и параориентантами (заместители первого рода).
2. электронно – акцепторные заместители проявляют М эффект и снижают электронную плотность в сопряженной системе, что в целом понижает реакционную способность бензольного ядра в реакциях замещения.
В наименьшей степени электронная плотность понижается в метаположениях, поэтому эти заместители направляют новые заместители в мета положения и поэтому называются
К ним относится нитрогруппа NO2, сульфа группа SO3H, карбонильная группа COOH.
Реакции с участием боковой цепи.
1. галогенирование
В этих реакциях алкильные радикалы боковой цепи ведут себя подобно алканам.
Влияние бензольного ядра проявляется в том что всегда замещаются атомы водорода у атома с непосредственно связанное с бензольным ядром.
Реакции с участием бензольного ядра.
1. галогенирование
При взаимодействии гомологов бензола с галогенами в присутствии катализаторов происходт замещение в бензольном ядре.
При недостатке галогена образуется смесь орто- и параизомеров, а в случае избытка галогена тризамещенный продукт
2. нитрование
3. гидрирование
Способы получения:
1. Алкилирование бензола
2. дегидроциклизация алканов
2. Высушивание, прокаливание и взвешивание осадков в весовом анализе
На заключительной стадии анализа после промывания высушивают или прокаливают и в результате такой термической обработки получают соединение, пригодное для взвешивания. Соединение в виде которого производят взвешивание, называется гравиметрической формой.
Высушивание или прокаливание осадка продолжают до тех пор, пока масса его не станет постоянной. Осадки полученные в результате реакции с органическим осадителем обычно высушивают, осадки неорганических соединении – прокаливают. В зависимости от физико-химических свойств осадка при прокаливании он остается неизменным или претерпевает существенные химические превращения. Отсюда и вытекает главное требование к гравиметрической форме: необходимость точного соответствия ее состава определенной химической формуле, т.к. только тогда по массе осадка можно расчитать содержание анализируемого компонента в пробе. Осадок должен также обладать определенной химической устоичивостью в широком интервале температур. Желательно чтобы у гравиметрической формы была большая относительная молекулярная масса и содержание определяемого элемента в ней было как можно меньше. Чем меньше содержание анализир.элемента во взвешиваемом осадке, тем меньше будет сказываться погрешности взвешивания на результатах анализа.
3. Сущность хроматографического метода анализа. Методы расчета хроматограмм.
Хроматография – физико-химический метод разделения смесей соединений, основанный на распределении веществ между двумя фазами: одна фаза неподвижная, другая – подвижная, непрерывно протекающая через неподвижную фазу.
Как метод разделения хроматография применяется:
а) для анализа разделённых соединений (аналитическая хроматография);
б) для выделения разделённых веществ в чистом виде (препаративная хроматография);
в) для физико-химических исследований или измерений (физико-химические применения хроматографии, исследовательская хроматография).
В связи с этими назначениями хроматографии имеются и другие определения хроматографии.
Хроматография – физико-химический метод анализа сложных смесей (газов, жидкостей) путём предварительного разделения их при движении по слою сорбента за счёт различий взаимодействий и последующего определения разделяемых компонентов.
В отличие от других методов разделения, также основанных на распределении соединений между фазами, хроматография – динамический метод, так как разделение происходит в потоке одной из фаз. В хроматографии разделение соединений происходит за счёт различной сорбируемости. Самое главное требование – это обратимость взаимодействия, соединения должны сорбироваться и через некоторое время полностью десорбироваться потоком подвижной фазы.
В связи с этим требованием в хроматографии используют физическую адсорбцию, основанную на слабых межмолекулярных взаимодействиях, водородной связи, донорно-акцепторных взаимодействиях, слабом комплексообразовании и прочее.
Необратимая сорбция (хемосорбция) для хроматографического разделения не применяется, так как при необратимой сорбции соединения будут полностью поглощаться и информация о них на выходе из колонки будет потеряна.
Хроматографический метод – относительный метод анализа. Измеряемая концентрация на выходе сильно отличается от концентрации в анализируемой пробе. При вводе пробы в колонку она сразу же разбавляется в детекторе газом-носителем, при прохождении пробы через колонку происходит дополнительное размывание в результате на выходе концентрация компонентов совсем другая. Для проведения количественного анализа необходима градуировка – установление связи между первоначальными концентрациями в пробе и сигналами, полученными на выходе из колонки. Хроматограф – определяется как индивидуально градуируемая система.
Метод абсолютной градуировки. Метод заключается в построении графика зависимости площади или высоты пика от содержания соединения в пробе. При выполнении количественного анализа по методу абсолютной градуировки предъявляется высокие требования к точности и воспроизводимости дозирования пробы. Кроме того необходимо строго соблюдать тождественность условий при градуировке прибора и при реальных анализах. Наиболее воспроизводимое дозирование выполняется газовым краном-дозатором или специальными дозаторами жидкости.
Метод внутреннего стандарта. В методе внутреннего стандарта к известному количеству анализируемого образца добавляется известное количество не содержащегося в нём эталонного соединения – внутреннего стандарта.
Недостатки метода внутреннего стандарта:
трудности при выборе внутреннего стандарта в некоторых случаях;
необходимость подготовки пробы – добавка стандарта и возможное введение дополнительной погрешности.
Метод внутренней стандартизации. В методе внутренней нормализации процентное отношение анализируемого соединения в пробе определяют отношением его площади к сумме площадей всех компонентов на хроматограмме. В этом методе необходимо измерять количественные параметры всех пиков и приводить с помощью поправочных коэффициентов к единой шкале чувствительности детектирования.
Параметры хроматографического пика
Выходной сигнал анализируемого соединения имеет форму треугольника или пика, это обычно участок нулевой линии, на котором возникает сигнал при выходе анализируемого соединения из хроматографической колонки. Нулевая или базовая линия – это участок, соответствующий нулевой концентрации анализируемого соединения. Запись пика исследуемого соединения вместе с участками нулевой линии до и после пика называется хроматограммой. Высота пика – это расстояние от максимума пика до его основания, измеренное параллельно оси отклика детектора. Ширина пика у основания – это отрезок основания пика, отсекаемый двумя касательными, проведёнными в точках перегибов восходящей и нисходящей ветвей хроматографического пика. Ширина пика на полувысоте – это отсекаемый пиком отрезок линии, проведённой параллельно основанию пика на середине его высоты. Площадь пика – это площадь части хроматограммы, заключённой между пиком и его основанием.
Важным параметром пика является коэффициент асимметрии, который применяется для сравнения различных твёрдых носителей, адсорбентов и всей газовой системы хроматографа в целом. В идеальных условиях пик симметричен. На практике пики по разным причинам в основном несимметричны.
Асимметрия пиков ухудшает разделение и затрудняет количественную обработку.
Асимметричные пики появляются при разделении на неоднородных сорбентах. Асимметрию пиков оценивают относительно полуширин пиков на половине высоты (рис.1.2) отношением отрезка БВ к АБ, либо отношением отрезков ДЕ к ГД на 1/10 высоты пика от основания. Точнее пользоваться отношением площадей половин пика – отношением заштрихованной части пика к не заштрихованной
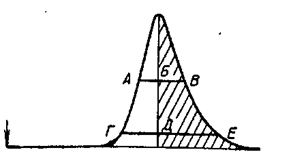 4. Техника безопасности при работе с агессивными веществами
Работ с концентрированными кислотами и щелочами проводятся только в вытяжном шкафу с использованием перчаток и очков.
При работе с дымящей азотной кислотой следует одевать резиновый фартук.
Используемые для работы концентрированные кислоты должны хранится в вытяжном шкафу в стеклянной посуде с емкостью не более 2 дм3.
В местах хранения кислот - не допустимо ЛВЖ. Разбавленные растворы кислот (за исключением плавиковой) так же хранят в стеклянной посуде, а щелочи в п/э таре. Переносить бутыли с кислотами разрешается вдвоем и только в корзинах, в промежутке которых заполнены стружкой более мелкие ёмкости с концентрированной кислотой и щёлочами следует переносить в спец.таре предохр-й от ожогов (ящики с ручкой).
Запрещается набирать кислоты и щелочи в пипетку ртом!!! Для этого следует применять резиновую грушу и прочие оборудования для отбора проб.
Для приготовления растворов серной, азотной и др.кислот необходимо их приливать к воде тонкой струёй при непрерывном перемешивании, а не наоборот. Приливать воду в кислоту ЗАПРЕЩАЕТСЯ!
Растворять твёрдый щелочи следует путём медленного добавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки нужно брать только щипцами.
При смешении в-в сопровож-я с выделением тепла необходимо пользоваться термостойкой, толстостенной стеклянной или фарфоровой посудой.
При попадании на кожу кислоты надо смыть её большим количеством воды, затем обработать 3-5% раствором питьевой соды или разбавленным раствором аммиака.
При попадании на кожу или одежду щёлочи, после смывания большим количеством воды нужно провести обработку 2-3% борной, лимонной или уксусной кислот.
4. Техника безопасности при работе с агессивными веществами
Работ с концентрированными кислотами и щелочами проводятся только в вытяжном шкафу с использованием перчаток и очков.
При работе с дымящей азотной кислотой следует одевать резиновый фартук.
Используемые для работы концентрированные кислоты должны хранится в вытяжном шкафу в стеклянной посуде с емкостью не более 2 дм3.
В местах хранения кислот - не допустимо ЛВЖ. Разбавленные растворы кислот (за исключением плавиковой) так же хранят в стеклянной посуде, а щелочи в п/э таре. Переносить бутыли с кислотами разрешается вдвоем и только в корзинах, в промежутке которых заполнены стружкой более мелкие ёмкости с концентрированной кислотой и щёлочами следует переносить в спец.таре предохр-й от ожогов (ящики с ручкой).
Запрещается набирать кислоты и щелочи в пипетку ртом!!! Для этого следует применять резиновую грушу и прочие оборудования для отбора проб.
Для приготовления растворов серной, азотной и др.кислот необходимо их приливать к воде тонкой струёй при непрерывном перемешивании, а не наоборот. Приливать воду в кислоту ЗАПРЕЩАЕТСЯ!
Растворять твёрдый щелочи следует путём медленного добавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки нужно брать только щипцами.
При смешении в-в сопровож-я с выделением тепла необходимо пользоваться термостойкой, толстостенной стеклянной или фарфоровой посудой.
При попадании на кожу кислоты надо смыть её большим количеством воды, затем обработать 3-5% раствором питьевой соды или разбавленным раствором аммиака.
При попадании на кожу или одежду щёлочи, после смывания большим количеством воды нужно провести обработку 2-3% борной, лимонной или уксусной кислот.
|
| Билет №25
1. Кислоты. Классификация, номенклатура. Химические свойства
Это сложные вещества молекулы которых состоят из атомов H и кислотного остатка.
В зависимости от количества атомов H, кислоты бывают одно- (HCl, HNO3), двух- (H2SO4, H2CO3) и трехосновные (H3PO4).
Если в молекуле кислоты присутствует атом кислорода, то кислородосодержащая кислота, если кислород отсутствует – бескислородная кислота.
Неорганические кислоты называются еще минеральными кислотами, по физическим свойствам: соляная кислота – бесцветная жидкость, с едким запахом.(концентрированная соляная кислота содержит 37%.
Серная кислота бесцветная маслянистая жидкость, почти в 2 раза тяжелее воды.
Азотная кислота – бесцветная жидкость в 1, 5 раза тяжелее воды.
Получение:
1) SO3 + H2O↔ H2SO4
2) Na2SiO3 + H2SO4 ↔ Na2SO4 + H2SiO3↓
Бескислородные кислоты получают синтезом Н с последующим растворением в воде.
2. Техника осаждения и фильтрования в весовом анализе
В ходе гравиметрического анализа определяемое в-во или отгоняется в виде какого-либо летучего соединения (метод отгонки), осаждается из раствора в виде малорастворимого соединения (метод осаждения). Метод осаждения применяется более широко, и их практическое значение намного больше, чем метод отгонки.
Методы осаждения:
Осаждение, фильтрование и промывание осадка, высушивание или прокаливание, взвешивание, расчет результата анализа.
Соединение в виде которого определяемый компонент осаждается из раствора, называется формой осаждения. (ВаSО4).
К форме осаждения предъ.след.треб. 1)осадок д.б. малорастворимым, 2)должен быть чистым и легкофильтрующимся.
Решающее влияние на полноту осаждения и свойства осадков оказывают следующие условия (концентрация осадителя, температура, концентрация посторонних солей.
Для фильтрования осадков в количественном анализе используют так называемые беззольные фильтры, остаток после озоления которых меньше чувствительности аналитических весов (0, 00003-0, 00007г)
В зависимости от размеров частиц полученного осадка применяют бумажные фильтры разной степени пористости.
1) синяя лента – для мелкозернистых осадков – наиболее плотные фильтры,
2) белая или черная лента (менее плотные)– для осадков крупнокристаллических и аморфных
Размер фильтра определяется величиной осадка, а не объемом фильтруемой жидкости. Только 1/3 фильтра должна быть заполнена осадком. Размер воронки подбирают так, чтобы края фильтра были на 0, 5-1 см ниже края воронки.
При сливании жидкости на фильтр пользуются стеклянной палочкой. Нижний конец палочки должен близко подходить к фильтру, но не касаться бумаги. Правой рукой берут стакан с фильтруемой жидкостью, прикладывают носик стакана к палочке и осторожно сливают жидкость на фильтр, пока он не будет наполнен на 2/3.
Осадок на фильтре промывают небольшими порциями промывной жидкости, т.к. при одинаковом объеме промывной жидкости многократная промывка небольшими порциями более эффективна
3. Детекторы. Сущность метода детектирования
Классификация детекторов. Всего для газовой хроматографии предложено более 60 типов детектирующих систем. По общепринятой классификации детекторы подразделяются на дифференциальные и интегральные по форме зарегистрированного сигнала. Дифференциальные детекторы измеряют мгновенное различие в концентрации вещества в потоке газа-носителя. Хроматограмма зарегистрированная таким детектором представляет собой ряд пиков, площадь которых пропорциональна количеству разделенных соединений. Интегральные детекторы измеряют суммарные количества соединений, выходящих из колонки. Хроматограмма в этом случае ступенчатая, высота ступеней пропорциональна количеству соответствующих соединений.
В зависимости от однократной или многократной регистрации молекул анализируемых соединений выделяют концентрационные и потоковые детекторы. В концентрационных детекторах сигнал пропорционален концентрации соединения в подвижной фазе (элюенте). В этом случае имеет место многократная регистрация молекул анализируемых соединений. В потоковых (или массовых) детекторах сигнал пропорционален количеству пробы компонента, достигаемый ячейки детектора в единицу времени. В этом случае происходит только однократная регистрация.
По селективности детекторы классифицируются на универсальные, селективные и специфические. В универсальных детекторах регистрируются все компоненты смеси, выходящие из колонки, за исключением подвижной фазы. Селективные детекторы регистрируют определенные группы соединений на выходе из колонки. Специфические детекторы регистрируют только один компонент или ограниченное число компонентов с подобными химическими характеристиками.
Основные технические характеристики детекторов.
Чувствительность или предел детектирования.
Линейность (динамический диапазон).
Инерционность (постоянная времени, быстродействие).
Стабильность (уровень шума и дрейфа).
Величина эффективного объема чувствительной ячейки.
Механизм работы детекторов
Пламенноионизационный детектор (ПИД) основан на ионизации органических соединений в пламени водорода. Точный механизм ионизации пока еще не выяснен. С использованием масспектрометрометра проведено исследование и обнаружено, что механизм ионообразования связан с термодекструкцией с последующей хемиионизацией.
Детектор по теплопроводности (ДТП) (катарометр)
Чувствительными элементами в ДТП являются нагретые нити (филаменты) из специальных металлов (платина, вольфрам, вольфрам-рений и др.), помещенные в специальные камеры, продуваемые газом – носителем. Филаменты включены в плечи моста Уинстона через сравнительную камеру проходит поток чистого газа-носителя, через рабочую камеру газ-носитель с примесями разделяемых соединений. Сопротивление нитей зависит от температуры. При изменении состава газа в рабочем камере теплопроводность его изменяется, изменяется теплопередача от нити к стенкам камеры и изменяется температура нити и, следовательно, сопротивление нити по сравнению с сопротивлением нити в сравнительной камере. Происходит разбаланс моста, возникает сигнал на нулевой линии.
4. Профессиональные заболевания. Профилактика.
Проф.заболевания бывают острые и хронические.
Расследование и учету подлежат острые и хран. проф.забол., кот. возникли у раб-ов под воздействием вредных произв. факторов при выполнении ими труд. обязанностей.
Острое проф.заболевание – это забол-ие явл-ся результатом однократного (в теч. не более 1 раб. дня, 1 раб. смены) воздействие на раб-ка вредного производственного фактора и повлекшее временную или стойкую утрату профессиональной трудоспособности.
Хроническое проф.заболевание –это забол-ие явл-ся результатом длительного воздей-ия на раб-ка вредного произ.фактора и повлекшее временную или стойкую утрату проф.трудоспособности.
Проф.заб. расслед-ся комиссией под председательством главного врача Роспотребнадзора.
Члены комиссии:
-представитель работодателя
-спец-т по ОТ
-пред-ль мед.учреж-я
-пред-ль профсоюз.органа
-пред-ль ФСС
По рез-ам расслед.акт «О случае проф.заб-ия» в 5 экз.: работника, работодателя, ФСС, мед.учр-я, Роспотребнадзор. Данный акт хран-ся 75 лет у работодателя и в Роспотребнадзора.
Профилактика проф.заб.:
1.Проведение медосмотров
2.Применение средств индив-ой и коллективной защиты
3.Внедрение научно-технического прогресса (дистанц-ое упр-ие)
4.Здоровый образ жизни.
Обязательное соц.страх-ие от Н.С. на произ-ве и проф.заб-ий.
125-ФЗ от 24.07.98г. с изм. и дополнениями.
Виды обесп-ия по страхованию:
1.Пособие по врем. нетрудоспособности (100% не зависимо от стажа работы)
2.Выплаты единовр-ые, ежемес-ые
3.Оплата доп.расходов, связанных от стажа с мед-й, соц-ой, проф-ой реабилитации застрах-го.
На лечение застрах-го санаторно-кур-го лечение, преобр-е лекарств, изг-ие и ремонт протезов и т.д.
|
Билет №26
1. Ароматические углеводороды. Свойства бензола.
Ароматические углеводороды – это большой класс органических соединений молекула которых содержит один или несколько циклов из шести атомов углерода с чередующимися одинарными и двойными связями.
Простейшим ароматическим углеводородом является бензол (С6Н6)
Углеводороды бензольного ряда имеют общее название – арены.
Химические свойства
Ароматичность определяет ароматические свойства бензола. Шести электронная π система является более устойчивой, чем обычная 2-х электронная π связь, поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для предельных углеводородов.
Наиболее характерные для реакции замещения, т.о. ароматические углеводороды по своим химическим свойствам занимают промежуточные положения между предельными и непредельными.
1. Реакции замещения (галогенирование)
2. Реакции присоединения
- гидрирование
- хлорирование
3. Реакции окисления
2. Аналитические реакции. Требования, предъявляемые к аналитическим реакциям
Аналитические реакции должны быть:
Характерными, т.е. присущими только анализируемому компоненту.
Достаточно интенсивными. Чем выше интенсивность св-ва, тем меньшее кол-во компонента можно анализировать, т.е. тем чувствительнее метод.
Неизменными (устойчивыми) по своим параметрам при изменении в определенном диапазоне условии анализа.
Однозначно связанными с природой и составом анализируемого компонента.
В кислотно-основных реакциях измеряется рН и фиксируется изменение цвета индикатора; о-в реакциях изменяется электродный потенциал, фиксируется появление (перманганатометрия) или исчезновение (иодометрия) цвета в результате появления избытка одного из участков реакции.
Реакции, в которых достигаются указанные эффекты, принято называть аналитическими реакциями.
Они отличаются практически необратимым характером и высокой скоростью протекания, а также стехиометричностью. Желательно, чтобы они были избирательными и чувствительными.
3. Количественный анализ. Методы расчета хроматограмм.
Хроматографический метод – относительный метод анализа. Измеряемая концентрация на выходе сильно отличается от концентрации в анализируемой пробе. При вводе пробы в колонку она сразу же разбавляется в детекторе газом-носителем, при прохождении пробы через колонку происходит дополнительное размывание в результате на выходе концентрация компонентов совсем другая. Для проведения количественного анализа необходима градуировка – установление связи между первоначальными концентрациями в пробе и сигналами, полученными на выходе из колонки. Хроматограф – определяется как индивидуально градуируемая система.
Метод абсолютной градуировки. Метод заключается в построении графика зависимости площади или высоты пика от содержания соединения в пробе. При выполнении количественного анализа по методу абсолютной градуировки предъявляется высокие требования к точности и воспроизводимости дозирования пробы. Кроме того необходимо строго соблюдать тождественность условий при градуировке прибора и при реальных анализах. Наиболее воспроизводимое дозирование выполняется газовым краном-дозатором или специальными дозаторами жидкости.
Метод внутреннего стандарта. В методе внутреннего стандарта к известному количеству анализируемого образца добавляется известное количество не содержащегося в нём эталонного соединения – внутреннего стандарта.
Недостатки метода внутреннего стандарта:
трудности при выборе внутреннего стандарта в некоторых случаях;
необходимость подготовки пробы – добавка стандарта и возможное введение дополнительной погрешности.
Метод внутренней стандартизации. В методе внутренней нормализации процентное отношение анализируемого соединения в пробе определяют отношением его площади к сумме площадей всех компонентов на хроматограмме. В этом методе необходимо измерять количественные параметры всех пиков и приводить с помощью поправочных коэффициентов к единой шкале чувствительности детектирования.
Параметры хроматографического пика
Выходной сигнал анализируемого соединения имеет форму треугольника или пика, это обычно участок нулевой линии, на котором возникает сигнал при выходе анализируемого соединения из хроматографической колонки. Нулевая или базовая линия – это участок, соответствующий нулевой концентрации анализируемого соединения. Запись пика исследуемого соединения вместе с участками нулевой линии до и после пика называется хроматограммой. Высота пика – это расстояние от максимума пика до его основания, измеренное параллельно оси отклика детектора. Ширина пика у основания – это отрезок основания пика, отсекаемый двумя касательными, проведёнными в точках перегибов восходящей и нисходящей ветвей хроматографического пика. Ширина пика на полувысоте – это отсекаемый пиком отрезок линии, проведённой параллельно основанию пика на середине его высоты. Площадь пика – это площадь части хроматограммы, заключённой между пиком и его основанием.
Важным параметром пика является коэффициент асимметрии, который применяется для сравнения различных твёрдых носителей, адсорбентов и всей газовой системы хроматографа в целом. В идеальных условиях пик симметричен. На практике пики по разным причинам в основном несимметричны.
Асимметрия пиков ухудшает разделение и затрудняет количественную обработку.
Асимметричные пики появляются при разделении на неоднородных сорбентах. Асимметрию пиков оценивают относительно полуширин пиков на половине высоты (рис.1.2) отношением отрезка БВ к АБ, либо отношением отрезков ДЕ к ГД на 1/10 высоты пика от основания. Точнее пользоваться отношением площадей половин пика – отношением заштрихованной части пика к не заштрихованной
 4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
|

 4. Действие электрического тока на организм человека, защита от воздействия электрического тока.
Электробезопасность –это система организационных и технических мероприятий и средств, обеспечивающих защиту людей от вредного и опасного воздействия эл.тока, эл.дуги, эл.-магн.поля, стат.эл-ва.
Факторы опасного и вредного воздействия на человека:
Протекание эл.тока через организм человека, воздействие эл.дуги, воздействие эл.стат.поля, эл.-магн.излучения.
Опасные и вредные последствия для человека проявл-ся в виде эл.травм (металлизация кожи, эл.знаки и ожоги, электроофтальмия, резкое сокращение мышц, фибрилляция сердца, элекролиз крови) механических повреждений и проф.заболеваний.
Степень воздействия зависит от:
-рода и величины напряжения и тока
-частоты эл.тока
-путей тока через тело человека
-продолжительности воздействия эл.тока
-условий внешней среды.
Меры защиты:
- защитное заземление
- зануление
- защитное отключение
- применение низких напряжений (12, 36, 42 Вт)
- двойная изоляция
- ограждение неизолированных токоведущих частей и расположение их на недоступной высоте.
4. Действие электрического тока на организм человека, защита от воздействия электрического тока.
Электробезопасность –это система организационных и технических мероприятий и средств, обеспечивающих защиту людей от вредного и опасного воздействия эл.тока, эл.дуги, эл.-магн.поля, стат.эл-ва.
Факторы опасного и вредного воздействия на человека:
Протекание эл.тока через организм человека, воздействие эл.дуги, воздействие эл.стат.поля, эл.-магн.излучения.
Опасные и вредные последствия для человека проявл-ся в виде эл.травм (металлизация кожи, эл.знаки и ожоги, электроофтальмия, резкое сокращение мышц, фибрилляция сердца, элекролиз крови) механических повреждений и проф.заболеваний.
Степень воздействия зависит от:
-рода и величины напряжения и тока
-частоты эл.тока
-путей тока через тело человека
-продолжительности воздействия эл.тока
-условий внешней среды.
Меры защиты:
- защитное заземление
- зануление
- защитное отключение
- применение низких напряжений (12, 36, 42 Вт)
- двойная изоляция
- ограждение неизолированных токоведущих частей и расположение их на недоступной высоте.
 4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
 4. Техника безопасности при работе с агессивными веществами
Работ с концентрированными кислотами и щелочами проводятся только в вытяжном шкафу с использованием перчаток и очков.
При работе с дымящей азотной кислотой следует одевать резиновый фартук.
Используемые для работы концентрированные кислоты должны хранится в вытяжном шкафу в стеклянной посуде с емкостью не более 2 дм3.
В местах хранения кислот - не допустимо ЛВЖ. Разбавленные растворы кислот (за исключением плавиковой) так же хранят в стеклянной посуде, а щелочи в п/э таре. Переносить бутыли с кислотами разрешается вдвоем и только в корзинах, в промежутке которых заполнены стружкой более мелкие ёмкости с концентрированной кислотой и щёлочами следует переносить в спец.таре предохр-й от ожогов (ящики с ручкой).
Запрещается набирать кислоты и щелочи в пипетку ртом!!! Для этого следует применять резиновую грушу и прочие оборудования для отбора проб.
Для приготовления растворов серной, азотной и др.кислот необходимо их приливать к воде тонкой струёй при непрерывном перемешивании, а не наоборот. Приливать воду в кислоту ЗАПРЕЩАЕТСЯ!
Растворять твёрдый щелочи следует путём медленного добавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки нужно брать только щипцами.
При смешении в-в сопровож-я с выделением тепла необходимо пользоваться термостойкой, толстостенной стеклянной или фарфоровой посудой.
При попадании на кожу кислоты надо смыть её большим количеством воды, затем обработать 3-5% раствором питьевой соды или разбавленным раствором аммиака.
При попадании на кожу или одежду щёлочи, после смывания большим количеством воды нужно провести обработку 2-3% борной, лимонной или уксусной кислот.
4. Техника безопасности при работе с агессивными веществами
Работ с концентрированными кислотами и щелочами проводятся только в вытяжном шкафу с использованием перчаток и очков.
При работе с дымящей азотной кислотой следует одевать резиновый фартук.
Используемые для работы концентрированные кислоты должны хранится в вытяжном шкафу в стеклянной посуде с емкостью не более 2 дм3.
В местах хранения кислот - не допустимо ЛВЖ. Разбавленные растворы кислот (за исключением плавиковой) так же хранят в стеклянной посуде, а щелочи в п/э таре. Переносить бутыли с кислотами разрешается вдвоем и только в корзинах, в промежутке которых заполнены стружкой более мелкие ёмкости с концентрированной кислотой и щёлочами следует переносить в спец.таре предохр-й от ожогов (ящики с ручкой).
Запрещается набирать кислоты и щелочи в пипетку ртом!!! Для этого следует применять резиновую грушу и прочие оборудования для отбора проб.
Для приготовления растворов серной, азотной и др.кислот необходимо их приливать к воде тонкой струёй при непрерывном перемешивании, а не наоборот. Приливать воду в кислоту ЗАПРЕЩАЕТСЯ!
Растворять твёрдый щелочи следует путём медленного добавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки нужно брать только щипцами.
При смешении в-в сопровож-я с выделением тепла необходимо пользоваться термостойкой, толстостенной стеклянной или фарфоровой посудой.
При попадании на кожу кислоты надо смыть её большим количеством воды, затем обработать 3-5% раствором питьевой соды или разбавленным раствором аммиака.
При попадании на кожу или одежду щёлочи, после смывания большим количеством воды нужно провести обработку 2-3% борной, лимонной или уксусной кислот.
 4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.
4. Санитарно-бытовое обслуживание работников.
Согл.ст.223 ТК РФ обесп. санитарно-бытов.обслуживания раб-ка возлагаются на работодателя.
В этих целях по установленным нормам оборуд-ся:
-санитарно-бытовые помещения (гардеробные, душевые, умывальные, туалеты, помещ. для отдыха в раб. время, сушки спец.одежды и обуви).
Пропускная способность санитарно-бытов.помещения зависит от численности раб-их.
-помещения для приёма пищи
-помещения для оказания медпомощи
-санитарные посты с аптечками
-аппараты для обеспечения рабочих соленой газовой водой.