
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Розчини електролітів. Гідроліз солей
|
|
Мета: оволодіти теоретичними положеннями даної теми і навчитись вирішувати задачі, виконувати вправи, складати рівняння гідролізу солей в молекулярному та йонному вигляді, освоїти методику вимірювання рН за допомогою рН-метра.
Дослід 1. Якісне визначення електропровідності води та водних розчинів.
Прилади, посуд та реактиви: прилад для якісного визначення електропровідності, склянки на 100 – 200 мл, розчини HCl, NaOH, NaCl, NH4OH, CH3COOH конц., CH3COOH розб., C12H22O11 (цукор), вода водопровідна і вода дистильована.
Методика виконання (дослід демонструє лаборант або викладач).У сім склянок налити по 20 – 30 мл розчинів HCl, NaOH, NaCl, NH4OH, цукру і водопровідну та дистильовану воду. У кожну з цих склянок опускають електроди, які ввімкнені в електромережу і приєднані послідовно до електричної лампочки через вимикач. Періодично і короткочасно вмикають струм і спостерігають за лампою. Помічають, у яких випадках є світіння і яка його інтенсивність. Дають пояснення своїм спостереженням, записують рівняння електролітичної дисоціації, відмічають силу електроліта.
В окрему склянку наливають 5 – 10 мл концентрованої ацетатної кислоти і перевіряють її електропровідність. Тоді поступово доливають воду і одночасно спостерігають за зміною інтенсивності світіння електричної лампи. Що спостерігається і як це математично пояснити? Написати рівняння електролітичної дисоціації і вираз константи дисоціації ацетатної кислоти. Знайти табличне значення константи дисоціації цієї кислоти.
Дослід 2. Зміщення рівноваги процесу дисоціації слабких електролітів.
Посуд і реактиви: чотири пробірки, водний розчин ацетатної кислоти, водний розчин амоніаку, розчини індикаторів метилоранжу і фенолфталеїну.
Методика виконання: 1. У перші дві пробірки наливають близько 0, 5 – 1 мл розбавленої ацетатної кислоти і приливають по 2 краплини розчину метилоранжу, розчин в обох пробірках стає червоним. В одну з цих пробірок всипають 1 – 2 мікрошпателя сухого натрій ацетату і розмішують розчин скляною паличкою. Червоне забарвлення помітно послаблюється. Чому? Дайте пояснення.
2. У другі дві пробірки наливають по 0, 5 – 1 мл розчину амоній гідроксиду NH3·H2O і прибавляють 1 – 2 краплі фенолфталеїну, розчин набуває малинового кольору. В одну з пробірок вносять 1 – 2 мікрошпателя амоній хлориду NH4Cl. Чому послаблюється забарвлення?
Дослід 3. Визначення константи дисоціації ацетатної кислоти.
Ацетатна кислота як слабкий електроліт дисоціює за рівнянням:
СН3СООН↔ Н+ + СН3СОО–
переважна дуже мало дуже мало
більшість
Константа дисоціації ацетатної кислоти має вираз:
Кд = [Н+][СН3СОО–]
[СН3СООН]
де концентрація [Н+] = [СН3СОО–], [Н+] дорівнює антилогарифму з рН. Значення рН визначають точно рН-метром (тип рН 340; рН 121) або наближено (універсальним індикаторним папером, тут точність визначення рН ~ 0, 5).
Щоб розрахувати константу дисоціації оцтової кислоти дослідним шляхом, визначають значення рН не менше як трьох розчинів різної концентрації. Виходячи з рівностей рН = –lg[Н+] і [Н+] = [СН3СОО–] а [СН3СООН] рівноважна ~ [СН3СООН] загальна, де [СН3СООН] загальна вихідна концентрація кислоти, одержимо Кдис ~ [Н+]2 /Сзаг.
Прилади і реактиви: рН-метр типу рН 340 або рН 121; 1; 0, 1 і 0, 01 моль/л розчини СН3СООН, універсальний індикаторний папір, три склянки на 100 мл, дистильована вода, фільтрувальний папір.
Хід досліду (разом з викладачем і лаборантом). Підготуйте рН-метри до роботи (промийте дистильованою водою електроди, встановіть необхідний інтервал рН ~ 0 – 4, виставіть температуру, яка є в лабораторії). Візьміть три склянки з 30 – 50 мл розчинів ацетатної кислоти з концентрацією 1; 0, 1 і 0, 01 моль/л у кожній окремій склянці. Виміряйте величину рН кожного розчину (після кожного вимірювання електрод промивають дистильованою водою і витирають фільтрувальним папером). Якщо рН-метра у лабораторії немає, то визначте величину рН наближено за допомогою універсального індикаторного паперу. Одержані з досліду і розраховані дані занесіть у таблицю:
| Концентрація кислоти (С заг.) | рН розчину | [Н+] | [Н+]2 | Кдис. |
| 1, 0 0, 1 0, 01 |
З одержаних Вами трьох значень Кдис візьміть середнє і порівняйте його з табличною величиною Кдис СН3СООН = 1, 7·10–5.
Дослід 4. Йонні реакції у розчинах електролітів.
Посуд і реактиви: розчини BaCl2, Na2SO4; Pb(NO3)2, Na2CrO4; Na2CO3, HCl; Cr2(SO4)3 і KOH; чотири пробірки.
У першій пробірці до розчину BaCl2 доливають розчин Na2SO4, у другій – до розчину Pb(NO3)2 – розчин Na2CrO4, у третій – до розчину Na2CO3 – розчин HCl, у четвертій – до розчину Cr2(SO4)3 надлишок розчину KOH. В усіх випадках об’єми розчинів беруть у кількостях 5 – 10 крапель, або 0, 2 – 0, 5 мл. Які зміни спостерігаються у кожній пробірці? Скласти молекулярні, повні йонні та скорочені йонні рівняння усіх реакцій, які Ви виконали. Зазначте, яка умова спричиняє перебіг кожної реакції (тобто чому відбувається дана реакція).Який склад йонів (і катіонів, і аніонів) у водному розчині? Порівняйте табличні значення добутків розчинності BaSO4 і PbCrO4. Яка сіль менше розчинна?
Дослід 5. Визначення збільшення температури кипіння розчину натрій хлориду порівняно з водою.
Прилади, посуд і реактиви: термометр на 110 – 120º С, термостійка склянка на 500 мл, скляна паличка, сухий NaCl, дистильована вода, шпатель, технічні терези, пінцет, різноважки, мірний циліндр на 100 мл, штатив з лапкою і кільцем, металева тринога, азбестова сітка, газовий пальник, сірники.
На технічних терезах відважують 5, 85 г NaCl і розчиняють цю наважку у 90 мл дистильованої води, яка налита у склянку на 150 мл. Цю склянку через фіксуюче металеве кільце штатива ставлять в більшу склянку з водою, велику склянку (об’ємом 500 – 600 мл) ставлять на азбестову сітку металевої триноги. У розчині натрій хлориду розміщують термометр, який за допомогою лапки штатива фіксують у постійному положенні (у середній частині об’єму розчину). Обережно нагрівають склянки з водою і розчином і визначають температуру кипіння розчину натрій хлориду, одержане значення записують в лабораторний зошит. Потім замість розчину в малу склянку наливають дистильовану воду і визначають температуру кипіння чистої води. За даними досліду визначають Δ t кип. розчину як різницю:
Δ t кип. розчину = t кип. розчину –t кип. води.
Теоретичний розрахунок Δ t кип. розчину виконують, виходячи з таких даних:
Кеб Н2О = 0, 52; коефіцієнт активності розчину дорівнює 0, 9; ступінь дисоціації NaCl α = 80 %, а Δ t кип. розчину = i Кеб Н2О ·  ·
· 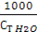 ;
; 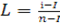 . α = L.
. α = L.
Порівнюють дослідне та теоретичне значення Δ t кип. розчину. Чим Ви можете пояснити різницю в значеннях цих величин? Тут скористайтесь поняттям “ідеальні розчини” і “розбавлені розчини”.
Дослід 6. Вплив температури на розчинність плюмбум (II) йодиду PbI2.
Посуд, пристрої і реактиви: пробірка, концентровані водні розчини Pb(NO3)2 і KI, газовий пальник, держак для пробірки, сірники, скляна паличка, штатив для пробірок.
У пробірку з 2 – 3 мл розчину Pb(NO3)2 доливають стільки ж розчину KI, спостерігають утворення жовтого осаду PbI2. Пробірку з осадом закріплюють у держаку і обережно нагрівають на слабкому полум’ї газового пальника, постійно струшуючи пробірку або розмішуючи суміш у пробірці скляною паличкою до повного розчинення осаду. Пробірку з гарячим прозорим розчином залишають у штативі для пробірок. Що спостерігається після охолодження розчину? Як залежить розчинність PbI2 від температури? Напишіть рівняння реакції одержання PbI2 в молекулярній, повній йонній та скороченій йонній формах.
Дослід 7. Визначення кольору індикаторів у різних середовищах.
Посуд і реактиви: 9 пробірок, розчини індикаторів метилоранжу, лакмусу і фенолфталеїну, розчини хлоридної кислоти і натрій гідроксиду, дистильована вода.
Беруть три ряди пробірок по три пробірки у кожному ряду. У першу пробірку наливають розчин хлоридної кислоти, у другу – дистильовану воду, у третю – розчин натрій гідроксиду. У перший ряд пробірок додають по 2 краплі розчину метилоранжу, у другий ряд – розчину лакмусу, у третій ряд – розчину фенолфталеїну. Спостерігають за кольором індикаторів у кожному випадку. Одержані дані записують у таблицю:
| Індикатор | Кисле середовище | Нейтральне середовище | Лужне середовище |
| Метилоранж | |||
| Лакмус | |||
| Фенолфталеїн |
Дослід 8. Визначення рН водних розчинів.
Прилади, реактиви і матеріали: рН-метр типу рН 340 або рН 121, універсальний індикаторний папір, скляна паличка, водні розчини кислоти, лугу, солей NH4Cl, Na2CO3, п’ять склянок на 100 мл.
Готують рН-метр до роботи, як описано у досліді 3, а тоді визначають рН досліджуваних розчинів з точністю до ±0, 1. Для кожного розчину визначають рН наближено за допомогою універсального індикаторного паперу, одержані дані записують у таблицю:
| Розчин | Значення рН за показами рН-метра (±0, 1) | Значення рН за шкалою універсального індикатора (±0, 5) |
| HCl NH4Cl Na2CO3 NaOH |
Для яких рідких харчових продуктів визначають величину рН і чому?
Дослід 9. Приготування ацетатного буферного розчину і його властивості.
Посуд і реактиви: три склянки на 100 мл, 1 моль/л розчин ацетатної кислоти, 1 моль/л розчин натрій ацетату, 0, 1 моль/л розчин HCl, 0, 1 моль/л розчин NaOH, скляна паличка, пробірки, мірні піпетки на 5 мл, мірний циліндр на 25 мл, універсальний індикаторний папір, дистильована вода.
В окремих склянках готують 0, 1 моль/л розчини CH3COOH і CH3COONa розбавленням 1 мл їх 1 моль/л розчинів водою до 10 мл (1 мл розчину і 9 мл води). В третю склянку відміряють мірним циліндром по 10 мл 0, 1 моль/л розчинів CH3COOH і CH3COONa. Універсальним індикаторним папером визначають рН одержаного буферного розчину.
Беруть чотири пробірки, у першу і третю наливають воду, а у другу і четверту по 1 мл буферного розчину. У перші дві пробірки додають по 1 краплині 0, 1 моль/л розчину HCl, а у других дві пробірки по 1 краплині 0, 1 моль/л розчину NaOH. Визначають рН одержаних чотирьох розчинів. Як пояснити те, що у другій і четвертій пробірках рН практично не змінюється? Напишіть відповідні рівняння реакцій, які це пояснюють.
Дослід 10. Визначення рН середовища розчинів різних солей.
Посуд і реактиви: п’ять пробірок, сухі солі Na2CO3, AlCl3, CH3COONH4, NaCl, універсальний індикаторний папір, шпатель, дистильована вода. В п’ять пробірок наливають по 2 – 3 мл дистильованої води, в перші чотири пробірки вносять по 0, 2 – 0, 3 г солей Na2CO3, AlCl3, CH3COONH4 і NaCl, розмішують вміст пробірок і за допомогою універсального індикатора визначають рН цих розчинів. Одержані дані записують у таблицю:
| Формула солі | рН розчину | Рівняння гідролізу солі в йонній формі |
| Na2CO3 | ||
| AlCl | ||
| CH3COONH4 | ||
| NaCl |
Дайте відповідь, які речовини піддають гідролізу у харчовій промисловості і для якої мети?
Дослід 11. Повний гідроліз карбонату хрому (III).
Посуд і реактиви: пробірка, розчин солі хрому (III), розчин натрій карбонату Na2CO3.
У пробірку з розчином солі хрому(III) (0, 2 – 0, 3 мл) додають стільки ж розчину Na2CO3, спостерігають утворення сіро – синюватого осаду хром (III) гідроксиду. Напишіть рівняння повного гідролізу в процесі перебігу цієї реакції в молекулярній та йонній формах. Чому сіль Cr2(CO3)3 не можливо одержати у водному розчині?
Дослід 12. Дослідження впливу температури на гідроліз натрій ацетату.
Посуд, матеріали і реактиви: дві пробірки, розчини фенолфталеїну і натрій ацетату, газовий пальник, держак пробірок, сірники.
У дві пробірки наливають по 1 мл розчину натрій ацетату і додають у кожну з них по 1 краплині розчину фенолфталеїну. Який колір розчину в пробірках? Нагрійте одну з цих пробірок, порівняйте тепер інтенсивність кольору індикатора в цих же пробірках. Де інтенсивність забарвлення більша і чому? Охолодіть нагрітий розчин. Як змінилась інтенсивність забарвлення? Зробіть висновок про вплив нагрівання та охолодження на процес гідролізу.
Дослід 13. Вплив розведення на гідроліз солі.
Посуд, матеріали і реактиви: пробірка, концентрований розчин солі SbCl3 або BiCl3, дистильована вода, скляна паличка, універсальний індикаторний папір.
У пробірку налийте 0, 2 – 0, 5 мл концентрованого розчину солі і розбавляйте його водою при збовтуванні або розмішуванні. Що спостерігається і чому? Напишіть рівняння поступового гідролізу SbCl3 з утворенням на першій стадії Sb(OH)Cl2, на другій – Sb(OH)2Cl, який переходить в стійкий SbOCl, відщеплюючи воду. SbOCl при кімнатній температурі стійкий, але при високих температурах зазнає термогідролізу:
2SbOCl + H2O = Sb2O3 + 2HCl↑.
Завдання та запитання для самопідготовки
1. Розрахуйте рН і рОН 0, 001, 0, 01 і 0, 1 моль/л розчинів ацетатної кислоти, якщо Кд СН3СООН = 1, 7·10–5; а також рН і рОН 0, 01; 0, 1 і 1 моль/л розчинів диметиламіну у воді, якщо Кд (СН3)2NH·H2O= 5, 4·10–4 .
2. 1, 713 г барій гідроксиду міститься у 2 л водного розчину. Яка величина рН цього розчину?
3. У склянці змішали 200 мл 0, 1 моль/л розчину KOH і 800 мл 0, 04 н розчину сульфатної кислоти. Вирахуйте рН розчину після змішування.
4. До 250 мл розчину AgNO3, який містить 0, 001 г цієї солі, прилили 750 мл розчину KBr (вміст солі 0, 002 г). Чи випаде осад, якщо ДРAgBr = 5, 3 ·10–13? Відповідь підтвердіть розрахунком.
5. Розрахуйте температуру кипіння та замерзання водного розчину натрій карбонату, якщо 10, 6 г цієї солі розчинено у 180 г води, де α = 90 %; Кеб = 0, 52; Ккр = 1, 86, де α – ступінь електролітичної дисоціації Na2CO3.
6. При розчиненні солей SbCl3, SnCl2, BiCl3 у воді одержані розчини стають каламутними. Чому це відбувається? Напишіть необхідні рівняння в молекулярній та йонній формах. Яким чином можна усунути помічене явище?
7. Напишіть рівняння реакцій гідролізу амоній карбонату, калій ацетату, амоній сульфату в молекулярній та йонній формах. Яке середовище цих розчинів внаслідок гідролізу?
8. У якому масовому співвідношенні необхідно брати натрій хлорид і сніг, щоб одержана суміш танула при мінус 10º С, якщо Ккр Н2О = 1, 86; ступінь дисоціації натрій хлориду α = 95%.
9. Обчисліть рН і ступінь гідролізу (α) 0, 1 н розчину NH4Cl, Кд NH3·H2O = 1, 8 ·10–5.
10. Добуток розчинності BaSO4 дорівнює 1, 1·10–10. Розрахуйте розчинність цієї солі в моль/л.
|
|